Bortribromid (BBr3) ist eine chemische Verbindung, die als Katalysator in verschiedenen Reaktionen verwendet wird. Es besteht aus einem Boratom und drei Bromatomen.
| IUPAC-Name | Bortribromid |
| Molekularformel | BBr3 |
| CAS-Nummer | 10294-33-4 |
| Synonyme | Tribromboran; Borbromid; Bor(III)bromid; Bromobor; Bortribromid, [B(Br)3]; Tribromboran |
| InChI | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Eigenschaften von Bortribromid
Bortribromid-Formel
Die Formel für Borbromid lautet BBr3. Es besteht aus einem Boratom und drei Bromatomen. Diese chemische Verbindung entsteht durch die Kombination von Bor und Brom.
Molmasse von Bortribromid
Die Molmasse von Borbromid (BBr3) kann durch Addition der Atommassen von Bor und drei Bromatomen berechnet werden. Bor hat eine Atommasse von etwa 10,81 Gramm pro Mol und Brom hat eine Atommasse von etwa 79,90 Gramm pro Mol. Die Molmasse von BBr3 beträgt also etwa 250,60 Gramm pro Mol.
Siedepunkt von Bortribromid
Borbromid hat einen relativ niedrigen Siedepunkt. Es beginnt bei etwa 91 Grad Celsius (196 Grad Fahrenheit) zu kochen. Bei dieser Temperatur vollzieht die Verbindung einen Phasenwechsel von einer Flüssigkeit zu einem Gas, wobei BBr3-Dämpfe freigesetzt werden.
Bortribromid Schmelzpunkt
Der Schmelzpunkt von Borbromid ist relativ hoch. Bei etwa -46 Grad Celsius (-51 Grad Fahrenheit) beginnt es zu schmelzen. Bei dieser Temperatur geht die feste Verbindung in den flüssigen Zustand über.
Dichte von Bortribromid g/ml
Borbromid hat eine Dichte von etwa 2,63 Gramm pro Milliliter (g/ml). Diese Dichte gibt die Masse an BBr3 an, die in einem Milliliter der Verbindung vorhanden ist. Es ist ein Maß für die Kompaktheit bzw. Konzentration des Stoffes.
Molekulargewicht von Bortribromid
Das Molekulargewicht von Borbromid (BBr3) wird durch Addition der Atommassen von Bor und drei Bromatomen berechnet. Das Molekulargewicht von BBr3 beträgt etwa 250,60 Gramm pro Mol.
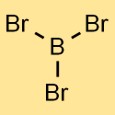
Struktur von Bortribromid
Die Struktur von Borbromid besteht aus einem Boratom, das an drei Bromatome gebunden ist. Die Anordnung bildet eine trigonal-planare Geometrie, bei der sich das Boratom im Zentrum befindet und die drei Bromatome gleichmäßig darum herum verteilt sind.
Löslichkeit von Bortribromid
Borbromid ist eine sehr reaktive Verbindung und im Allgemeinen in Wasser schlecht löslich. Es neigt dazu, mit Wasser unter Bildung von Bromwasserstoffsäure und Borsäure zu reagieren. BBr3 ist jedoch in organischen Lösungsmitteln wie Chloroform, Tetrachlorkohlenstoff und Schwefelkohlenstoff löslich.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 2,63 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 250,60 g/Mol |
| Dichte | 2,63 g/ml |
| Fusionspunkt | -46°C |
| Siedepunkt | 91°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Chloroform, CCl4 und Schwefelkohlenstoff |
| Dampfdruck | 78 mmHg |
| Wasserdampfdichte | 6,52 (Luft=1) |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Bortribromid
Borbromid birgt einige Sicherheitsrisiken und beim Umgang mit dieser Verbindung ist Vorsicht geboten. Es wirkt ätzend auf Haut, Augen und Atemwege. Direkter Kontakt kann zu Verbrennungen und schweren Reizungen führen. Das Einatmen seiner Dämpfe kann zu Atembeschwerden führen. Es reagiert heftig mit Wasser und setzt giftige Dämpfe frei. Daher sollte die Handhabung in einem gut belüfteten Bereich erfolgen und geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrillen getragen werden. Es muss vor Feuchtigkeit und unverträglichen Substanzen geschützt gelagert werden. Bei Exposition ist sofortige ärztliche Hilfe erforderlich. Um die mit Borbromid verbundenen Risiken zu minimieren, sollten geeignete Sicherheitsprotokolle und -richtlinien befolgt werden.
| Gefahrensymbole | Ätzend, bei Nässe gefährlich |
| Sicherheitsbeschreibung | Kontakt mit Haut, Augen und Kleidung vermeiden. In einem gut belüfteten Bereich verwenden. Tragen Sie Handschuhe und Schutzbrille. |
| UN-Identifikationsnummern | UN3264 |
| HS-Code | 2811.19.9000 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Giftig beim Einatmen und Verschlucken; verursacht schwere Hautverbrennungen und Augenschäden. |
Methoden zur Synthese von Bortribromid
Borbromid kann auf verschiedene Weise synthetisiert werden. Eine gängige Methode beinhaltet die Reaktion zwischen Boroxid (B2O3) und Brom (Br2). Die Reaktion findet in Gegenwart eines Katalysators wie Kohlenstoff oder Aluminium bei erhöhten Temperaturen statt. Die resultierende Reaktion erzeugt Borbromid und setzt Sauerstoffgas frei.
Eine andere Methode beinhaltet die Reaktion zwischen Bortrichlorid (BCl3) und Brom. Diese Reaktion findet bei Raumtemperatur statt und bildet als Nebenprodukte Borbromid und Chlorgas.
Zur Herstellung von Borbromid kann Bor in einer kontrollierten Umgebung mit überschüssigem Brom umgesetzt werden, was hohe Temperaturen und eine sorgfältige Kontrolle der Reaktionsbedingungen erfordert.
Eine andere Methode besteht darin, Borbromid durch Reaktion von Borhydriden wie Diboran (B2H6) oder Boran (BH3) mit Bromwasserstoff (HBr) zu synthetisieren. Bei dieser Reaktion entstehen als Produkte Borbromid und Wasserstoffgas.
Bedenken Sie, dass diese Synthesemethoden aufgrund der hochreaktiven Natur von Borbromid Vorsicht erfordern. Während des Syntheseprozesses sollten angemessene Sicherheitsprotokolle befolgt werden, wie das Tragen geeigneter Schutzausrüstung und das Arbeiten in einem gut belüfteten Bereich.
Verwendung von Bortribromid
Borbromid (BBr3) hat mehrere wichtige Anwendungen in verschiedenen Branchen. Hier sind einige wichtige Anwendungen:
- Katalysator: BBr3 katalysiert aktiv organische Synthesereaktionen und ermöglicht Prozesse wie Acylierungs-, Alkylierungs- und Halogenierungsreaktionen.
- Chemische Zwischenprodukte: BBr3 fungiert als Vorläufer bei der Herstellung anderer Borverbindungen und synthetisiert borhaltige Reagenzien, Boronsäuren und Polymere auf Borbasis.
- Polymerisation: BBr3 nimmt aktiv an Polymerisationsreaktionen teil, insbesondere bei der Herstellung von Polymeren wie Polyethylen und Polypropylen, und dient als Lewis-Säure-Katalysator.
- Dotierungsmittel: Die Halbleiterindustrie nutzt BBr3 aktiv als Dotierungsmittel und modifiziert die elektrischen Eigenschaften von Silizium für die Eignung in elektronischen Geräten.
- Gaserkennung: BBr3 reagiert aktiv mit bestimmten Gasen wie Ammoniak und eignet sich daher für Gasdetektoren und Sensoren zur Erkennung und Überwachung.
- Laborreagenz: BBr3 dient aktiv als Reagens in verschiedenen Laborexperimenten und Forschungen, führt Bromierungsreaktionen durch und fungiert als Quelle für Bromatome in der synthetischen Chemie.
- Pharmazeutische Synthese: Die Pharmaindustrie nutzt BBr3 aktiv bei der Synthese bestimmter Arzneimittel und pharmazeutischer Zwischenprodukte.
Aufgrund seiner ätzenden und reaktiven Natur ist es wichtig, sorgfältig mit Borbromid umzugehen und die entsprechenden Sicherheitsprotokolle einzuhalten.
Fragen:
F: Welcher Begriff beschreibt die Reaktivität von Bortribromid (BBr3)?
A: Sehr reaktionsschnell.
F: Wie lautet die Formel für Bortribromid?
A: Die Formel für Borbromid lautet BBr3.
F: Wie viele Boratome sind in 3,24 Gramm Bortribromid enthalten?
A: In 3,24 Gramm sind 0,053 Mol BBr3 enthalten, was 0,159 Mol Bor oder etwa 9,62 x 10^22 Atomen entspricht.
F: Wie viele Gramm Bortribromid können aus 3,49 Gramm Brom hergestellt werden?
A: Die Molmasse von BBr3 beträgt 250,60 g/mol. Aus etwa 3,49 Gramm Brom können also etwa 3,34 Gramm Borbromid entstehen.
F: Wie heißt die Verbindung mit der Formel BBr3?
A: Die Verbindung mit der Formel BBr3 heißt Borbromid.
F: Ist Bortribromid polar oder unpolar?
A: Borbromid ist eine polare Verbindung.
F: Wie ist die elektronische Geometrie von BBr3?
A: Die elektronische Geometrie von BBr3 ist planar trigonal.
F: Wie ist die Lewis-Struktur für BBr3?
A: In der Lewis-Struktur von BBr3 befindet sich im Zentrum ein Boratom, umgeben von drei Bromatomen.
F: Wie viele Spitzen gibt es in BBr3?
A: Borbromid (BBr3) hat einen Peak in seinem NMR-Spektrum.
