Natriumborat ist eine Verbindung, die in verschiedenen Industriezweigen verwendet wird. Es findet vielfältige Anwendungsmöglichkeiten: als Reinigungsmittel, Flussmittel in der Metallurgie und Bestandteil von Kosmetika und Reinigungsmitteln.
| IUPAC-Name | Natriumborat |
| Molekularformel | Na2B4O7 |
| CAS-Nummer | 1330-96-4 |
| Synonyme | Borax, Natriumtetraborat, Dinatriumtetraborat, Natriumbiborat |
| InChI | InChI=1S/B4O7.2Na/c5-1-7-3-9-2-8-4-10-3;;/q-2;2*+1 |
Eigenschaften von Natriumborat
Natriumborat-Formel
Die chemische Formel für Natriumborat lautet Na2B4H20O17. Es besteht aus zwei Natriumatomen (Na), vier Boratomen (B) und sieben Sauerstoffatomen (O). Die Formel stellt das Verhältnis jedes Elements in der Verbindung dar.
Molmasse von Natriumborat
Die Molmasse von Borax wird durch Addition der Atommassen aller Atome in der Verbindung berechnet. Die Molmasse von Borax beträgt etwa 381,37 Gramm pro Mol (g/mol). Es ist nützlich, um die in einer bestimmten Probe vorhandene Substanzmenge zu bestimmen.
Siedepunkt von Natriumborat
Borax hat einen relativ hohen Siedepunkt. Bei normalem Atmosphärendruck siedet es bei etwa 1,575 Grad Celsius (C). Aufgrund seines hohen Siedepunkts eignet es sich für verschiedene industrielle Anwendungen mit Hochtemperaturprozessen.
Natriumborat Schmelzpunkt
Borax hat einen Schmelzpunkt von etwa 741 Grad Celsius (C). Bei dieser Temperatur vollzieht es einen Phasenübergang vom festen in den flüssigen Zustand. Der relativ niedrige Schmelzpunkt ermöglicht, dass Borax leicht schmilzt und in verschiedenen Herstellungsprozessen verwendet werden kann.
Dichte von Natriumborat g/ml
Die Dichte von Borax beträgt etwa 1,73 Gramm pro Milliliter (g/ml). Die Dichte ist ein Maß für die Massemenge, die in einem bestimmten Volumen enthalten ist. Die relativ hohe Dichte von Borax macht es zu einer nützlichen Verbindung für Anwendungen, bei denen sein Gewicht oder seine Konzentration wichtig sind.
Molekulargewicht von Natriumborat
Das Molekulargewicht von Borax beträgt etwa 381,37 Gramm pro Mol (g/mol). Es stellt die Summe der Atomgewichte aller Atome in einem Boraxmolekül dar. Das Molekulargewicht ist für verschiedene Berechnungen von entscheidender Bedeutung, beispielsweise für die Bestimmung der Molzahl oder der Masse einer Substanz.
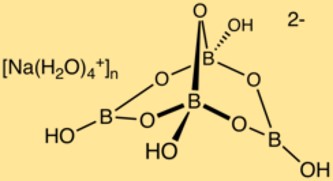
Struktur von Natriumborat
Borax hat eine komplexe Kristallstruktur, die aus Bor-Sauerstoff-Polyedern und Natriumionen besteht. Die Boratome bilden mit den Sauerstoffatomen ein Netzwerk und bilden so eine dreidimensionale Struktur. In dieser Struktur befinden sich Natriumionen, die für die Stabilität der Verbindung sorgen.
Löslichkeit von Natriumborat
Borax ist in Wasser mäßig löslich. Es löst sich leicht in heißem Wasser und seine Löslichkeit nimmt mit der Temperatur zu. Allerdings ist seine Löslichkeit in organischen Lösungsmitteln begrenzt. Die Löslichkeit von Borax macht es für eine Vielzahl von Anwendungen nützlich, unter anderem als Reinigungsmittel und bei der Formulierung von Lösungen und Mischungen.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 1,73 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 381,37 g/Mol |
| Dichte | 1,73 g/ml |
| Fusionspunkt | 741°C |
| Siedepunkt | 1575°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, begrenzte Löslichkeit in organischen Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Etwa 9-10 Uhr |
Sicherheit und Gefahren von Natriumborat
Aufgrund potenzieller Sicherheitsrisiken sollte Borax mit Vorsicht gehandhabt werden. Bei direktem Kontakt oder Einatmen kann es zu Reizungen der Haut, Augen und Atemwege kommen. Die Einnahme großer Mengen kann zu Magen-Darm-Beschwerden führen. Bei der Arbeit mit Borax sollten Schutzmaßnahmen wie Handschuhe und Schutzbrillen getragen werden, um eine Exposition zu vermeiden. Es ist wichtig, es an einem sicheren, gut belüfteten Ort und fern von unverträglichen Substanzen aufzubewahren. Bei Verschlucken oder versehentlicher Exposition sollte sofort ein Arzt aufgesucht werden. Für detaillierte Informationen zu den Gefahren und Sicherheitsvorkehrungen von Borax sollten die entsprechenden Sicherheitsdatenblätter und Handhabungsanweisungen konsultiert werden.
| Gefahrensymbole | Giftig |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken. Verursacht Haut- und Augenreizungen. |
| UN-Identifikationsnummern | UN 1458 |
| HS-Code | 2840.19.20 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Mäßige Toxizität bei Verschlucken oder Haut-/Augenkontakt. |
Methoden zur Synthese von Natriumborat
Es gibt verschiedene Methoden zur Synthese von Borax. Eine gängige Methode ist die Reaktion zwischen Borax (Natriumtetraborat-Decahydrat) und Natriumcarbonat . Lösen Sie dabei Borax in Wasser auf und geben Sie dann Natriumcarbonat zur Lösung hinzu. Die Reaktion findet statt, wobei Borax entsteht und ein Feststoff ausfällt. Trennen und trocknen Sie den Feststoff, um Borax zu erhalten.
Eine andere Methode besteht darin, Borsäure in Wasser aufzulösen und der Lösung nach und nach Natriumhydroxid hinzuzufügen. Die Reaktion findet statt und bildet Borax. Verdampfen Sie die Lösung, um überschüssiges Wasser zu entfernen und Boraxkristalle zu erhalten.
Mischen Sie außerdem Boroxid mit Natriumhydroxid in einem geeigneten Lösungsmittel und erhitzen Sie die Mischung. Die Reaktion findet statt und bildet Borax. Filtrieren Sie die Mischung, um Verunreinigungen abzutrennen, und lassen Sie das Filtrat abkühlen und kristallisieren, wodurch Borax entsteht.
Diese Synthesemethoden bieten Wege zur kontrollierten Gewinnung von Borax. Es ist jedoch wichtig, während des Syntheseprozesses die richtigen Sicherheitsvorkehrungen zu befolgen und verantwortungsvoll mit Chemikalien umzugehen.
Verwendung von Natriumborat
Borax, auch Borax genannt, findet aufgrund seiner vielseitigen Eigenschaften vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Hier sind einige seiner häufigsten Anwendungen:
- Flussmittel in der Metallurgie: Es dient als Flussmittel bei Schweiß- und Lötanwendungen und trägt dazu bei, den Schmelzpunkt von Metallen zu senken und das Fließen von geschmolzenem Metall zu erleichtern.
- Flammhemmend: Es findet Anwendung als Flammschutzmittel in verschiedenen Materialien, einschließlich Zelluloseisolierung, Textilien und Holzprodukten.
- Glas und Keramik: Borax ist ein wesentlicher Bestandteil bei der Herstellung von Glas und Keramik. Es hilft, den Schmelzpunkt zu senken, die Haltbarkeit zu verbessern und die optischen Eigenschaften dieser Materialien zu verbessern.
- pH-Puffer: Er fungiert als pH-Puffer in Labors und wissenschaftlichen Experimenten.
- Reinigungsmittel: Haushaltsprodukte wie Waschmittel, Spülmittel und Allzweckreiniger nutzen Borax effektiv als Reinigungsmittel.
- Kosmetika: Kosmetika und Körperpflegeprodukte verwenden Borax als Puffermittel, pH-Regler und Emulgator.
- Konservierungsmittel: Holzprodukte enthalten Borax als Konservierungsmittel, um Pilz- und Insektenbefall vorzubeugen.
- Landwirtschaft: Borax fungiert als Mikronährstoffdünger, um Bormangel in Nutzpflanzen zu beheben und so ein gesundes Pflanzenwachstum zu fördern.
- Medizinische Anwendungen: Medizinische Formulierungen enthalten Borax wegen seiner antiseptischen und adstringierenden Eigenschaften.
- Wasseraufbereitung: Wasseraufbereitungsprozesse nutzen Borax, um das Algenwachstum zu hemmen und den pH-Wert zu kontrollieren.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Borax in verschiedenen Branchen und machen es zu einer wertvollen und vielseitigen Verbindung.
Fragen:
F: Wofür wird Natriumborat verwendet?
A: Borax wird als Reinigungsmittel, Flussmittel in der Metallurgie, Bestandteil in Kosmetika, Flammschutzmittel, in der Glas-/Keramikherstellung, als Holzschutzmittel usw. verwendet.
F: Wo kann man Natriumborat kaufen?
A: Borax kann bei verschiedenen Chemielieferanten, Baumärkten, Online-Märkten und einigen Lebensmittelgeschäften gekauft werden.
F: Was wird das Kation sein, wenn sich das Natriumborat auflöst?
A: Das beim Auflösen von Borax freigesetzte Kation ist Natrium (Na+).
F: Ist Natriumborat dasselbe wie Borsäure?
A: Nein, Borax und Borsäure sind unterschiedliche Verbindungen, obwohl sie beide Bor enthalten.
F: Ist Natriumborat dasselbe wie Borax?
A: Ja, Borax wird allgemein als Borax bezeichnet.
F: Basiert Natriumborat?
A: Borax wirkt in wässrigen Lösungen als schwache Base.
F: Ist Natriumborat trinkbar?
A: Borax sollte nicht eingenommen werden, da es giftig sein kann. Es ist nicht zum Verzehr bestimmt.
F: Neutralisiert Natriumborat Schwefelsäure?
A: Nein, Borax neutralisiert Schwefelsäure nicht. Es kann reagieren, wird es aber nicht vollständig neutralisieren.
F: Welche Funktion hat Natriumborat im Elutionspuffer mit pH 10?
A: Borax im Elutionspuffer pH 10 erleichtert die Elution negativ geladener Biomoleküle aus Chromatographiesäulen.
F: Was ist Borax?
A: Borax, auch Natriumborat genannt, ist eine natürlich vorkommende Mineralverbindung, die aus Natrium-, Bor-, Sauerstoff- und Wassermolekülen besteht.
F: Was passiert, wenn Borax stark erhitzt wird?
A: Wenn Borax stark erhitzt wird, dehydriert es und verliert seine Wassermoleküle, was zur Bildung von wasserfreiem Borax führt.
F: Ist Borax dasselbe wie Borsäure?
A: Nein, Borax und Borsäure sind unterschiedliche Verbindungen. Borax ist Natriumborat, während Borsäure eine saure Form von Bor ist.
F: Was ist Borax-Pulver?
A: Unter Borax-Pulver versteht man die pulverförmige Form von Borax, die für verschiedene Zwecke wie Reinigung, Wäsche und Handwerk verwendet wird.
