Silberoxid (Ag2O) ist eine chemische Verbindung aus Silber und Sauerstoff. Es wird häufig als Oxidationsmittel und Katalysator bei verschiedenen chemischen Reaktionen verwendet.
| IUPAC-Name | Silber(I)-oxid |
| Molekularformel | Ag2O |
| CAS-Nummer | 11113-88-5 |
| Synonyme | Silbermonoxid; Silberoxid (1+); Dioxosilber; Silberoxid, Di-Silber; Sauerstoff (2-) |
| InChI | InChI=1S/2Ag.O |
Eigenschaften von Silberoxid
Silberoxid-Formel
Die Formel für Silbermonoxid lautet Ag2O. Es besteht aus zwei Silberatomen (Ag), die an ein Sauerstoffatom (O) gebunden sind. Diese Formel stellt das Verhältnis der in der Verbindung vorhandenen Elemente dar.
Molmasse von Silberoxid
Die Molmasse von Silbermonoxid wird durch Addition der Atommassen seiner Bestandteile berechnet. Silber hat eine Atommasse von 107,87 g/mol und Sauerstoff hat eine Atommasse von 16,00 g/mol. Die Molmasse von Silbermonoxid beträgt daher etwa 231,87 g/mol.
Siedepunkt von Silberoxid
Silbermonoxid hat keinen eindeutigen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen kommt es zu einer chemischen Reaktion und zerfällt in metallisches Silber und Sauerstoffgas.
Schmelzpunkt von Silberoxid
Silbermonoxid hat einen Schmelzpunkt von etwa 280 °C (536 °F). Bei dieser Temperatur geht festes Silbermonoxid in einen flüssigen Zustand über. Der Schmelzpunkt gibt die Temperatur an, bei der die feste Form in die flüssige Form übergeht.
Dichte von Silberoxid g/ml
Die Dichte von Silbermonoxid beträgt etwa 7,14 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar. Die hohe Dichte von Silbermonoxid wird auf die schwere Atommasse von Silber zurückgeführt.
Molekulargewicht von Silberoxid
Das Molekulargewicht von Silbermonoxid wird durch Addition der Atommassen seiner Bestandteile berechnet. Das Molekulargewicht von Ag2O beträgt etwa 231,87 g/mol. Sie gibt Aufschluss über die Masse eines Mols der Verbindung.
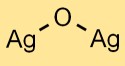
Silberoxidstruktur
Silbermonoxid hat eine kristalline Struktur. Die Silber- und Sauerstoffatome sind gitterartig angeordnet. Die Struktur besteht aus Ag^+-Kationen und O^2–Anionen, die durch Ionenbindungen zusammengehalten werden.
Löslichkeit von Silberoxid
Silbermonoxid ist in Wasser schlecht löslich. Es löst sich bis zu einem gewissen Grad auf und erzeugt Silberhydroxid (AgOH). Die Löslichkeit von Silbermonoxid kann durch den Einsatz saurer oder alkalischer Lösungen verbessert werden, die es in lösliche Silbersalze umwandeln.
| Aussehen | Einfarbig schwarz oder dunkelbraun |
| Spezifisches Gewicht | 7,14 g/cm³ |
| Farbe | Schwarz |
| Geruch | Geruchlos |
| Molmasse | 231,87 g/Mol |
| Dichte | 7,14 g/cm³ |
| Fusionspunkt | 280 °C (536 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in sauren oder alkalischen Lösungen |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Silberoxid
Treffen Sie beim Umgang mit Silbermonoxid Vorsichtsmaßnahmen, um Ihre Sicherheit zu gewährleisten. Das Verschlucken oder Einatmen kann schädlich sein und Haut, Augen und Atemwege reizen. Sorgen Sie für ausreichende Belüftung, um die Ansammlung von Staub oder Dämpfen zu verhindern. Tragen Sie Schutzausrüstung wie Handschuhe und Schutzbrille, um den Kontakt mit der Verbindung zu minimieren. Lagern Sie Silbermonoxid an einem kühlen, trockenen Ort, entfernt von brennbaren Materialien und unverträglichen Substanzen. Bei Verschlucken, Einatmen oder Hautkontakt sofort einen Arzt aufsuchen. Befolgen Sie die ordnungsgemäßen Handhabungs- und Entsorgungsverfahren, um eine Umweltverschmutzung zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken oder Einatmen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2841.90.90 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Mäßige Toxizität |
Methoden zur Silberoxid-Synthese
Es gibt verschiedene Methoden zur Synthese von Silbermonoxid.
Ein üblicher Ansatz beinhaltet die Reaktion zwischen einem löslichen Silbersalz wie Silbernitrat (AgNO3) und einem alkalischen Hydroxid wie Natriumhydroxid (NaOH) . Die Reaktion läuft durch Mischen wässriger Lösungen von Silbersalz und alkalischem Hydroxid ab, was zur Bildung eines Niederschlags aus Silbermonoxid führt. Sammeln Sie den Niederschlag und trocknen Sie ihn, um festes Silbermonoxid zu erhalten.
Eine andere Methode beinhaltet die thermische Zersetzung einer Silberverbindung, beispielsweise Silbernitrat oder Silbercarbonat. Erhitzen Sie die Verbindung auf eine bestimmte Temperatur, um ein Silbermonoxidprodukt zu bilden. Beim Zersetzungsprozess wird je nach verwendeter Ausgangsverbindung Stickstoffdioxid (NO2) oder Kohlendioxid (CO2) freigesetzt.
Verwenden Sie Elektrolyse, um Silbermonoxid zu synthetisieren. Bei dieser Methode wird ein elektrischer Strom durch eine Silberelektrode geleitet, die in eine geeignete Elektrolytlösung eingetaucht ist, die häufig Silbernitrat enthält. Es kommt zu einer Oxidation der Silberelektrode, was zur Bildung von Silbermonoxid auf der Elektrodenoberfläche führt.
Es ist zu beachten, dass die Wahl der Synthesemethode von Faktoren wie der gewünschten Reinheit, Ausbeute und der spezifischen Anwendung von Silbermonoxid abhängt. Befolgen Sie während der Synthese die entsprechenden Sicherheitsvorkehrungen, einschließlich der Verwendung geeigneter Schutzausrüstung und der Einhaltung der empfohlenen Verfahren.
Verwendungsmöglichkeiten von Silberoxid
Aufgrund seiner einzigartigen Eigenschaften findet Silbermonoxid vielfältige Anwendungsmöglichkeiten. Hier sind einige Verwendungsmöglichkeiten von Silbermonoxid:
- Oxidationsmittel: Organische Synthesereaktionen verwenden typischerweise Silbermonoxid als Oxidationsmittel, um Alkohole in Aldehyde oder Ketone umzuwandeln.
- Katalysator: Silbermonoxid fungiert als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich der Oxidation von Alkenen und Aldehyden und der Reduktion von Nitroverbindungen.
- Batterien: Knopfbatterien verwenden aufgrund seiner hohen Energiedichte und Stabilität Silbermonoxid als Kathodenmaterial.
- Antimikrobieller Wirkstoff: Silbermonoxid weist antimikrobielle Eigenschaften auf und eignet sich daher für Anwendungen wie Wundverbände, medizinische Geräte und Wasseraufbereitungssysteme.
- Leitfähige Paste: Bei der Herstellung elektronischer Produkte, darunter Leiterplatten und Dickschichtwiderstände, wird Silbermonoxid in leitfähigen Pasten verwendet.
- Fotoindustrie: Die Fotoindustrie nutzt Silbermonoxid aufgrund seiner lichtempfindlichen Eigenschaften, insbesondere in der Schwarzweißfotografie.
- Pyrotechnik: Pyrotechnische Mischungen nutzen Silbermonoxid, um bei Feuerwerkskörpern besondere Effekte und Farben zu erzeugen.
- Chemische Reagenzien: Laboratorien verwenden Silbermonoxid als chemisches Reagenz für verschiedene analytische und synthetische Verfahren.
- Glasherstellung: Spezialgläser wie Spiegelbeschichtungen verwenden aufgrund seiner reflektierenden Eigenschaften Silbermonoxid.
- Versilberung: Bei Versilberungsanwendungen wird manchmal Silbermonoxid verwendet, um eine dauerhafte, korrosionsbeständige Beschichtung zu erzielen.
Diese verschiedenen Anwendungen unterstreichen die Vielseitigkeit und Bedeutung von Silbermonoxid in verschiedenen Branchen.
Fragen:
F: Ist Ag2O wasserlöslich?
A: Ag2O ist in Wasser schlecht löslich.
F: Wie viele Gramm Ag2O hätten sich zersetzt, wenn bei P = 745 mmHg und T = 308 K 4,58 l O2 gebildet worden wären?
A: Die Masse des zersetzten Ag2O kann mithilfe der Stöchiometrie und des idealen Gasgesetzes berechnet werden.
F: Ist Ag2O ionisch?
A: Ja, Ag2O ist eine ionische Verbindung.
F: Warum heißt es Silberoxid und nicht Desilberoxid?
A: Die Namenskonvention für binäre ionische Verbindungen verwendet keine Präfixe wie „di-“. Deshalb wird es Silberoxid genannt.
F: Welches Disaccharid kann nicht mit Ag2O reagieren?
A: Ag2O reagiert nicht mit Disacchariden, da es hauptsächlich als Oxidationsmittel in der organischen Synthese verwendet wird.
F: Was ist Silberoxid?
A: Silbermonoxid (Ag2O) ist eine chemische Verbindung aus Silber und Sauerstoff, die häufig als Oxidationsmittel und Katalysator verwendet wird.
F: Können Alkali und Silberoxid austauschbar verwendet werden?
A: Alkali und Silberoxid sind möglicherweise nicht austauschbar, da sie unterschiedliche chemische Eigenschaften und Anwendungen haben.
F: Wie viele Mol Silber würden abgeschieden, wenn 0,632 Mol Blei zu Blei(II)-nitrat oxidiert würden?
A: Die Stöchiometrie der ausgeglichenen Gleichung würde die Anzahl der abgeschiedenen Mol Silber bestimmen.
F: Wie lange ist oxidiertes Silber haltbar?
A: Verschiedene Faktoren wie Umgebungsbedingungen und Wartung bestimmen die Langlebigkeit von oxidiertem Silber, aber durch die richtige Pflege kann es über lange Zeiträume erhalten bleiben.
