Zinknitrat (Zn(NO3)2) ist eine Verbindung, die Zink- und Nitrationen enthält. Es ist wasserlöslich und wird in der Industrie häufig für verschiedene Anwendungen verwendet, unter anderem als Katalysator und bei der Herstellung von Farbstoffen und Pigmenten.
| IUPAC-Name | Zinknitrat |
| Molekularformel | Zn(NO3)2 |
| CAS-Nummer | 7779-88-6 |
| Synonyme | Zinkdinitrat, Zinksalz der Salpetersäure, Celloxan, Zinknitrat |
| InChI | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
Eigenschaften von Zinknitrat
Zinknitrat-Formel
Die Formel für Zinkdinitrat lautet Zn(NO3)2. Es besteht aus einem Zinkion (Zn2+) und zwei NO3-Ionen, die durch Ionenbindungen zusammengehalten werden. Die Formel gibt das Verhältnis der in der Verbindung vorhandenen Elemente an.
Molmasse von Zinknitrat
Die Molmasse von Zinkdinitrat kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Die Atommasse von Zink (Zn) beträgt etwa 65,38 Gramm pro Mol, und die Atommasse von Stickstoff (N) und Sauerstoff (O) in NO3-Ionen beträgt etwa 14,01 bzw. 16,00 Gramm pro Mol. Daher beträgt die Molmasse von Zinkdinitrat etwa 189,38 Gramm pro Mol.
Siedepunkt von Zinknitrat
Zinkdinitrat hat keinen bestimmten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt es jedoch in Zinkoxid, Stickstoffdioxid und Sauerstoff. Diese Zersetzungsreaktion findet bei etwa 140 °C (284 °F) statt und setzt braune Stickstoffdioxiddämpfe frei.
Schmelzpunkt von Zinknitrat
Der Schmelzpunkt von Zinkdinitrat hängt von seinem Hydratationszustand ab. Die wasserfreie Form von Zinkdinitrat (Zn(NO3)2) schmilzt bei etwa 238 °C (460 °F). Allerdings hat die Hexahydratform (Zn(NO3)2·6H2O) einen niedrigeren Schmelzpunkt von etwa 36 °C (97 °F), da sie in ihrer Kristallstruktur Wassermoleküle enthält.
Dichte von Zinknitrat g/ml
Die Dichte von Zinkdinitrat variiert je nach Konzentration und Temperatur. Unter Standardbedingungen beträgt die Dichte der wasserfreien Form jedoch etwa 2,065 Gramm pro Milliliter (g/ml). Die Dichte der Hexahydratform ist aufgrund der Anwesenheit von Wassermolekülen etwas höher.
Molekulargewicht von Zinknitrat
Das Molekulargewicht von Zinkdinitrat wird durch Addition der Atommassen seiner Bestandteile berechnet. Das Molekulargewicht von Zinkdinitrat beträgt, wie bereits erwähnt, etwa 189,38 Gramm pro Mol.
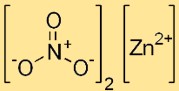
Struktur von Zinknitrat
Zinkdinitrat hat eine ionische Struktur, wobei das Zinkkation (Zn2+) von sechs Wassermolekülen in Hexahydratform umgeben ist. Nitrationen (NO3-) liegen als diskrete Einheiten im Kristallgitter vor.
Löslichkeit von Zinknitrat
Zinkdinitrat ist in Wasser sehr gut löslich. Die Löslichkeit nimmt mit der Temperatur zu. Bei Raumtemperatur können sich etwa 118 Gramm Zinkdinitrat in 100 Gramm Wasser lösen, was zu einer gesättigten Lösung führt.
| Aussehen | Farblose Kristalle |
| Spezifisches Gewicht | 2.065 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 189,38 g/Mol |
| Dichte | 2.065 g/ml |
| Fusionspunkt | 238°C (460°F) (wasserfrei) |
| Siedepunkt | Zersetzt sich (~140°C/284°F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | ~4 (wässrige Lösung) |
Sicherheit und Gefahren von Zinknitrat
Zinkdinitrat birgt einige Sicherheitsrisiken, die berücksichtigt werden müssen. Es ist wichtig, vorsichtig damit umzugehen, um mögliche Risiken zu vermeiden. Der Kontakt mit der Verbindung kann zu Haut- und Augenreizungen führen. Das Verschlucken oder Einatmen von Zinkdinitrat kann zu Magen-Darm-Beschwerden und Atembeschwerden führen. Bei der Arbeit mit Zinkdinitrat empfiehlt es sich, entsprechende Schutzmaßnahmen wie Handschuhe und Schutzbrille zu tragen. Darüber hinaus sollte es an einem gut belüfteten Ort und fern von unverträglichen Substanzen gelagert werden. Im Falle einer versehentlichen Exposition oder Einnahme wird empfohlen, einen Arzt zu konsultieren. Die Einhaltung geeigneter Sicherheitsprotokolle gewährleistet die sichere Handhabung und Verwendung von Zinkdinitrat.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Verschlucken und Einatmen vermeiden. Beim Umgang mit geeigneten Schutzmaßnahmen vorgehen. |
| UN-Identifikationsnummern | UN Nr. 1514 (wasserfrei), UN Nr. 1515 (Hexahydrat) |
| HS-Code | 28342990 |
| Gefahrenklasse | 5.1 (Oxidierende Stoffe) |
| Verpackungsgruppe | II (wasserfrei), III (Hexahydrat) |
| Toxizität | Mäßig giftig |
Methoden zur Zinknitrat-Synthese
Es gibt verschiedene Methoden zur Synthese von Zinkdinitrat. Ein gängiger Ansatz ist die Reaktion zwischen metallischem Zink und Salpetersäure . Bei dieser Methode reagiert Zink mit Salpetersäure zu Zinkdinitrat und setzt Wasserstoffgas frei. Die Bediener kontrollieren die Reaktion sorgfältig, um die Sicherheit zu gewährleisten.
Eine andere Methode beinhaltet die Reaktion zwischen Zinkoxid und Salpetersäure . Zinkoxid wird in Salpetersäure gelöst, wodurch Zinkdinitrat und Wasser entstehen. Diese Methode ist nützlich, wenn Zinkoxid leicht verfügbar ist.
Darüber hinaus kann Zinkcarbonat mit Salpetersäure unter Bildung von Zinkdinitrat reagieren. Das Carbonat reagiert mit Salpetersäure unter Bildung von Kohlendioxid, Wasser und Zinkdinitrat.
Es ist wichtig zu beachten, dass diese Reaktionen unter geeigneten Laborbedingungen und mit den erforderlichen Sicherheitsvorkehrungen durchgeführt werden müssen. Geeignete Schutzausrüstung wie Handschuhe und Schutzbrillen sollten getragen werden und Reaktionen sollten in einem gut belüfteten Bereich durchgeführt werden.
Insgesamt bieten diese Methoden effiziente Möglichkeiten zur Synthese von Zinkdinitrat und ermöglichen dessen Einsatz in verschiedenen industriellen Anwendungen.
Verwendung von Zinknitrat
Aufgrund seiner vielseitigen Eigenschaften findet Zinkdinitrat in verschiedenen Branchen Anwendung. Hier sind einige wichtige Anwendungen von Zinkdinitrat:
- Katalysator: Zinkdinitrat katalysiert verschiedene chemische Reaktionen und erleichtert so die Herstellung von Farbstoffen, Pharmazeutika und Polymeren.
- Galvanisieren: Beim Galvanisieren scheidet Zinkdinitrat eine Zinkschicht auf Metalloberflächen ab, die Korrosionsbeständigkeit verleiht und das Erscheinungsbild verbessert.
- Pigmente und Farbstoffe: Zinkdinitrat fungiert als Vorläufer bei der Herstellung von Pigmenten und Farbstoffen auf Zinkbasis, die für Farben, Beschichtungen und Textilien unerlässlich sind.
- Düngemittel: Zinkdinitrat dient als Zinkquelle in Düngemitteln und stellt sicher, dass Pflanzen ausreichend Nährstoffe für Wachstum und Entwicklung erhalten.
- Glasherstellung: Zinkdinitrat spielt eine wichtige Rolle bei der Glasherstellung und verbessert optische Eigenschaften wie Transparenz und Brechungsindex.
- Wasseraufbereitung: Zinkdinitrat spielt eine wesentliche Rolle in Wasseraufbereitungssystemen, indem es das Wachstum von Algen und Bakterien kontrolliert und die Wasserqualität aufrechterhält.
- Laborreagenz: In verschiedenen Laborexperimenten fungiert Zinkdinitrat aktiv als Reagenz, insbesondere in der analytischen Chemie und Forschung.
- Medizin und Pharmazeutika: Zinkdinitrat trägt aufgrund seiner antimikrobiellen Eigenschaften aktiv zu bestimmten pharmazeutischen Formulierungen und topischen Medikamenten bei.
- Flammschutzmittel: Zinkdinitrat ist ein wichtiger Bestandteil von Flammschutzformulierungen und reduziert aktiv die Entflammbarkeit von Materialien.
- Textilindustrie: Beim Färben und Bedrucken von Textilien verbessert Zinkdinitrat aktiv die Farbechtheit und verbessert die Farbstoffaufnahme.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Zinkdinitrat in zahlreichen Branchen und tragen zu einer Reihe von Produkten und Prozessen bei.
Fragen:
F: Ist Zinknitrat löslich?
A: Ja, Zinkdinitrat ist wasserlöslich.
F: Wie fällt man Zinkcarbonat aus Zinknitrat aus?
A: Um Zinkcarbonat aus Zn(NO3)2 auszufällen, fügen Sie der Zinkdinitratlösung Natriumcarbonat oder Natriumbicarbonatlösung hinzu, was zur Bildung von Zinkcarbonat als Niederschlag führt.
F: Reagiert Zink mit Silbernitrat?
A: Ja, Zn reagiert mit Silbernitrat, verdrängt das metallische Silber und bildet Zinkdinitrat.
F: Ist Zinknitrat ein Salz?
A: Ja, Zinknitrat ist ein Salz, das aus Zinkkationen (Zn2+) und NO3-Ionen besteht.
F: Was entsteht, wenn Zinknitrat mit Kaliumhydroxid reagiert?
A: Wenn Zn(NO3)2 mit Kaliumhydroxid reagiert, fällt Zn(OH)2 aus und es entsteht Kaliumnitrat.
F: Wie lautet die Formel für Lithiumzinknitrat?
A: Die Formel für Lithiumzinkdinitrat lautet LiZn(NO3)3.
F: Wie standardisiert man Magnesiumnitrat- und Zinknitratlösungen?
A: Zur Standardisierung von Magnesiumnitrat- und Zn-Dinitrat-Lösungen können Titrationsmethoden mit einem geeigneten standardisierten Reagenz verwendet werden.
F: Welche Säure und welches Metalloxid werden zur Herstellung von Zinknitrat verwendet?
A: Zur Herstellung von Zinkdinitrat werden Salpetersäure (HNO3) und Zinkoxid (ZnO) verwendet.
F: Welche Produkte entstehen, wenn Zink zu einer Bleinitratlösung hinzugefügt wird?
A: Wenn Zn zu einer Bleinitratlösung hinzugefügt wird, entstehen Zinkdinitrat und metallisches Blei.
F: Was ist Zinknitrat?
A: Zinkdinitrat ist eine chemische Verbindung bestehend aus Zinkkationen (Zn2+) und NO3-Anionen, die oft als kristalliner Feststoff vorkommt.
F: Wie viele Sauerstoffatome sind in 1,50 Mol Zn(NO3)2 enthalten?
A: In 1,50 Mol Zn(NO3)2 sind 9,00 Mol oder 27,00 Sauerstoffatome enthalten.
F: Welche Masse an Zn(NO3)2 sollte mit H2O auf eine Masse von 1,00 kg verdünnt werden, um 97 ppm Zn2+(aq) herzustellen?
A: Um eine Lösung mit 97 ppm Zn2+(aq) herzustellen, müssen etwa 97 mg Zn(NO3)2 mit Wasser auf eine Masse von 1,00 kg verdünnt werden.
