Phosphoroxychlorid (POCl3) ist eine chemische Verbindung, die in verschiedenen industriellen Prozessen verwendet wird. Es reagiert mit Wasser unter Bildung von Phosphorsäure und Salzsäure.
| IUPAC-Name | Phosphoroxychlorid |
| Molekularformel | POCl3 |
| CAS-Nummer | 10025-87-3 |
| Synonyme | Phosphorylchlorid, Phosphoryltrichlorid, Phosphortrichlorid |
| InChI | InChI=1S/Cl3OP/c1-4(2)3 |
Eigenschaften von Phosphoroxychlorid
Phosphoroxychlorid-Formel
Die chemische Formel für Phosphorylchlorid lautet POCl3. Es besteht aus einem Phosphoratom (P), symbolisiert durch P, und drei Chloratomen (Cl), symbolisiert durch Cl. Die Formel gibt das Verhältnis jedes in der Verbindung vorhandenen Elements an.
Molmasse von Phosphoroxychlorid
Die Molmasse von Phosphorylchlorid kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Phosphor hat eine Molmasse von 30,97 g/mol, während Chlor eine Molmasse von 35,45 g/mol hat. Die Multiplikation der Molmasse von Chlor mit 3 und die Addition der Molmasse von Phosphor ergibt eine Gesamtmolmasse von etwa 153,33 g/mol für Phosphorylchlorid.
Siedepunkt von Phosphoroxychlorid
Phosphorylchlorid hat einen Siedepunkt von etwa 105,5 °C. Diese Temperatur stellt den Punkt dar, an dem die flüssige Verbindung unter normalem Atmosphärendruck in den gasförmigen Zustand übergeht. Der Siedepunkt ist ein wichtiges Merkmal, das die Handhabung und Anwendung von Phosphorylchlorid beeinflusst.
Phosphoroxychlorid Schmelzpunkt
Der Schmelzpunkt von Phosphorylchlorid liegt bei etwa -112,5 °C. Damit ist die Temperatur gemeint, bei der die feste Verbindung in den flüssigen Zustand übergeht. Der Schmelzpunkt ist ein kritischer Parameter für Lagerung und Transport.
Dichte von Phosphoroxychlorid g/ml
Die Dichte von Phosphorylchlorid beträgt etwa 1,65 g/ml. Unter Dichte versteht man die Menge an Masse pro Volumeneinheit eines Stoffes. Eine höhere Dichte deutet auf eine größere Partikelkonzentration in einem bestimmten Volumen hin.
Molekulargewicht von Phosphoroxychlorid
Das Molekulargewicht von Phosphorylchlorid wird durch Addition der Atommassen seiner Bestandteile berechnet. Das Molekulargewicht von Phosphor beträgt etwa 30,97 g/mol, während Chlor ein Molekulargewicht von 35,45 g/mol hat. Durch Addition der gewichteten Massen ergibt sich für Phosphorylchlorid ein ungefähres Molekulargewicht von 153,33 g/mol.
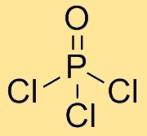
Struktur von Phosphoroxychlorid
Phosphorylchlorid hat eine Molekülstruktur, in der ein Phosphoratom an drei Chloratome und ein Sauerstoffatom gebunden ist. Die Chloratome sind symmetrisch um das zentrale Phosphoratom angeordnet, wobei auch das Sauerstoffatom an das Phosphoratom gebunden ist. Diese Anordnung bildet eine tetraedrische Geometrie.
Löslichkeit von Phosphoroxychlorid
Phosphorylchlorid ist in Wasser schlecht löslich, löst sich jedoch leicht in organischen Lösungsmitteln wie Benzol, Tetrachlorkohlenstoff und Chloroform. Sein Löslichkeitsverhalten wird auf die polare Natur des Moleküls und das Vorhandensein elektronegativer Atome wie Sauerstoff und Chlor zurückgeführt.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1.645 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 153,33 g/Mol |
| Dichte | 1.645 g/ml |
| Fusionspunkt | -112,5°C |
| Siedepunkt | 105,5°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert heftig |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Benzol, Tetrachlorkohlenstoff und Chloroform |
| Dampfdruck | 11 mmHg bei 20°C |
| Wasserdampfdichte | 5,29 (Luft = 1) |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Phosphoroxychlorid
Phosphorylchlorid stellt ein Sicherheitsrisiko dar und erfordert eine sorgfältige Handhabung. Es wirkt ätzend auf Haut, Augen und Atemwege. Bei Kontakt kann es zu schweren Verbrennungen und Augenschäden kommen. Das Einatmen seiner Dämpfe oder Dämpfe kann zu Reizungen der Atemwege führen. Bei der Arbeit mit dieser Verbindung sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Es sollte an einem gut belüfteten Ort und fern von Zündquellen gelagert werden. Bei Exposition ist sofortige ärztliche Hilfe erforderlich. Darüber hinaus muss es unter einem Abzug gehandhabt werden, um die Freisetzung giftiger Dämpfe zu vermeiden.
| Gefahrensymbole | Ätzend, Gefahr |
| Sicherheitsbeschreibung | Ätzend. Verursacht schwere Hautverbrennungen und Augenschäden. Kann beim Einatmen oder Verschlucken gesundheitsschädlich sein. Kontakt und Einatmen vermeiden. |
| UN-Identifikationsnummern | Ein 1810 |
| HS-Code | 2812.10.00 |
| Gefahrenklasse | Klasse 8 (ätzende Stoffe) |
| Verpackungsgruppe | Verpackungsgruppe III (geringe Gefahr) |
| Toxizität | Phosphorylchlorid ist giftig und kann schwerwiegende gesundheitliche Auswirkungen haben. |
Methoden zur Synthese von Phosphoroxychlorid
Phosphorylchlorid kann auf verschiedene Weise synthetisiert werden. Eine gängige Methode beinhaltet die Reaktion zwischen Phosphortrichlorid (PCl3) und Sauerstoff (O2). Bei diesem Verfahren wird PCl3 in Gegenwart von überschüssigem Sauerstoff erhitzt, um Phosphorylchlorid zu bilden. Die Reaktion ist exotherm und findet normalerweise in einer kontrollierten Umgebung, beispielsweise einem Reaktorbehälter, statt.
Eine weitere Synthesemethode beinhaltet die Reaktion zwischen Phosphorpentoxid (P2O5) und Phosphortrichlorid. P2O5 wirkt als Dehydratisierungsmittel und bildet in Kombination mit PCl3 Phosphorylchlorid.
Darüber hinaus kann Phosphorylchlorid durch die Reaktion von Phosphortribromid (PBr3) und Phosphorpentoxid synthetisiert werden. Diese Reaktion führt zur Bildung von Phosphorylchlorid und Phosphorpentabromid.
Darüber hinaus kann durch die direkte Chlorierung von Phosphor auch Phosphorylchlorid entstehen. Bei diesem Prozess strömt Chlorgas über erhitzten Phosphor, wodurch Phosphorylchlorid entsteht.
Es ist wichtig zu beachten, dass diese Synthesemethoden aufgrund der Reaktivität und Gefährlichkeit der beteiligten Verbindungen mit Vorsicht durchgeführt werden müssen. Um eine sichere Handhabung und Synthese von Phosphorylchlorid zu gewährleisten, müssen geeignete Sicherheitsprotokolle befolgt werden, einschließlich der Verwendung von Schutzausrüstung und kontrollierten Reaktionsbedingungen.
Verwendung von Phosphoroxychlorid
Aufgrund seiner einzigartigen Eigenschaften findet Phosphorylchlorid vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige häufige Verwendungszwecke:
- Chemische Synthese: In der organischen Chemie wird Phosphorylchlorid häufig als vielseitiges Reagenz zur Herstellung verschiedener Verbindungen verwendet, darunter Phosphonsäuren, Ester und Amide.
- Agrochemikalien: Bei der Synthese von Pestiziden und Herbiziden im Pflanzenschutz und in der Schädlingsbekämpfung spielt Phosphorylchlorid als Schlüsselbestandteil eine entscheidende Rolle.
- Pharmazeutische Industrie: Bei der Herstellung pharmazeutischer Zwischenprodukte und pharmazeutischer Wirkstoffe (APIs) wird Phosphorylchlorid verwendet, was die Synthese wichtiger Medikamente wie Malaria- und entzündungshemmender Medikamente erleichtert.
- Polymerindustrie: Bei der Polymerproduktion fungiert Phosphorylchlorid als Katalysator und Chlorierungsmittel und trägt zur Synthese flammhemmender Additive bei, die die Feuerbeständigkeit von Materialien verbessern.
- Herstellung von Farbstoffen und Pigmenten: Phosphorylchlorid findet Anwendung bei der Herstellung von Farbstoffen und Pigmenten, insbesondere bei der Herstellung von Chloralkylphosphonaten, Verbindungen, die für die Entwicklung von Farbstoffen für Textilien, Tinten und Beschichtungen unerlässlich sind.
- Laborreagenz: Verschiedene Laborverfahren verwenden Phosphorylchlorid als Reagenz, einschließlich der Umwandlung von Alkoholen in Alkylchloride und der Herstellung von Phosphorylierungsmitteln.
- Wasseraufbereitung: Bei der Wasseraufbereitung wird Phosphorylchlorid als Säuerungs- und Desinfektionsmittel eingesetzt, um den pH-Wert zu kontrollieren und Verunreinigungen zu entfernen.
- Flammschutzmittel: Phosphorylchlorid spielt eine Rolle bei der Herstellung flammhemmender Materialien und verbessert die Brandschutzeigenschaften von Textilien, Kunststoffen und Baumaterialien.
Diese vielfältigen Anwendungen verdeutlichen die Bedeutung von Phosphorylchlorid in vielen Industriezweigen und unterstreichen seine entscheidende Rolle in der chemischen Synthese, der Landwirtschaft, Pharmazeutik und Materialwissenschaft.
Fragen
F: Wie ist die Molekülgeometrie von POCl3?
A: Die Molekülgeometrie von POCl3 ist trigonal-pyramidal.
F: Welches Hauptalken entsteht, wenn Verbindung A mit POCl3 und Pyridin dehydratisiert wird?
A: Das bei der Dehydratisierung von Verbindung A mit POCl3 und Pyridin gebildete Hauptalken hängt von der spezifischen Struktur von Verbindung A ab.
F: Ist POCl3 polar oder unpolar?
A: POCl3 ist aufgrund der Anwesenheit polarer Bindungen und einer asymmetrischen Molekülform ein polares Molekül.
F: Wie viel POCl3-Gas kann produziert werden?
A: Die Menge des produzierten POCl3-Gases hängt von den Mengen der Reaktanten und den spezifischen Reaktionsbedingungen ab.
F: Wie viele Mol POCl3 sind in 10,0 Gramm POCl3 enthalten?
A: In 10,0 Gramm POCl3 sind etwa 0,082 Mol POCl3 enthalten.
F: Wie ist die Elektronenpaargeometrie für P in POCl3?
A: Die Elektronenpaargeometrie für P in POCl3 ist tetraedrisch.
F: Hat POCl3 ein Dipolmoment?
A: Ja, POCl3 hat aufgrund der Anwesenheit polarer Bindungen und seiner Molekülgeometrie ein Dipolmoment.
F: Hat POCl3 eine Resonanz?
A: Nein, POCl3 weist keine Resonanz auf, da es keine delokalisierten Elektronen oder Mehrfachresonanzstrukturen gibt.
F: Wie ist die Geometrie der elektronischen Domäne um das Sauerstoffatom in POCl3?
A: Die Geometrie der elektronischen Domäne um das Sauerstoffatom in POCl3 ist trigonal-pyramidal.
F: Welches Volumen an H3PO4 entsteht, wenn 72,3 Milliliter POCl3 vollständig reagieren?
A: Das Volumen an H3PO4, das entsteht, wenn 72,3 Milliliter POCl3 reagieren, hängt vollständig von der Stöchiometrie der Reaktion ab und kann nicht allein anhand der bereitgestellten Informationen bestimmt werden.
