Schwefeldichlorid (SCl₂) ist eine chemische Verbindung, die durch die Verbindung von Schwefel und Chlor entsteht. Es wird in verschiedenen Industrien zur Herstellung von Farbstoffen, Gummi und Pestiziden verwendet.
| IUPAC-Name | Schwefeldichlorid |
| Molekularformel | SCl₂ |
| CAS-Nummer | 10545-99-0 |
| Synonyme | Chlormonosulfid, schwefelhaltiges Chlorid, Schwefeldichlorid, Schwefelchlorid, Dichlorsulfan |
| InChI | InChI=1S/Cl2S/c1-3-2 |
Eigenschaften von Schwefeldichlorid
Schwefeldichlorid-Formel
Die Formel für Schwefelchlorid lautet SCl₂. Es stellt die Kombination aus einem Schwefelatom und zwei Chloratomen dar. Diese chemische Formel gibt die Zusammensetzung und Struktur der Verbindung genau wieder.
Molmasse von Schwefeldichlorid
Die Molmasse von Schwefelchlorid kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Schwefel hat eine Molmasse von 32,06 g/mol und Chlor hat eine Molmasse von 35,45 g/mol. Durch Addition der Massen von zwei Chloratomen und einem Schwefelatom ergibt sich die Molmasse von Schwefelchlorid zu etwa 102,91 g/mol.
Siedepunkt von Schwefeldichlorid
Schwefelchlorid hat einen Siedepunkt von 138,8 °C (281,8 °F). Diese Temperatur gibt den Punkt an, an dem die flüssige Verbindung unter normalem Atmosphärendruck in den gasförmigen Zustand übergeht. Bei der Handhabung oder Verwendung in verschiedenen Anwendungen ist es wichtig, den Siedepunkt von Schwefelchlorid zu berücksichtigen.
Schwefeldichlorid Schmelzpunkt
Der Schmelzpunkt von Schwefelchlorid beträgt -76,8 °C (-106,2 °F). Diese Temperatur stellt den Punkt dar, an dem die feste Verbindung in den flüssigen Zustand übergeht. Bei der Arbeit mit Schwefelchlorid ist es wichtig, den Schmelzpunkt zu kennen, um eine ordnungsgemäße Handhabung und Lagerung sicherzustellen.
Dichte von Schwefeldichlorid g/ml
Schwefelchlorid hat eine Dichte von etwa 1,64 g/ml. Der Dichtewert gibt die Masse pro Volumeneinheit des Stoffes an. Diese Eigenschaft ist wichtig, um das Verhalten und die Eigenschaften von Schwefelchlorid in verschiedenen Zusammenhängen zu verstehen, beispielsweise bei chemischen Reaktionen oder um seine Eignung für bestimmte Anwendungen zu bestimmen.
Molekulargewicht von Schwefeldichlorid
Das Molekulargewicht von Schwefelchlorid beträgt etwa 102,91 g/mol. Es stellt die Gesamtmasse eines Moleküls der Verbindung dar, berechnet durch Addition der Atommassen seiner Bestandteile. Das Molekulargewicht liefert wertvolle Informationen über die Masse der Verbindung und ermöglicht präzise Messungen in verschiedenen chemischen Berechnungen.
Struktur von Schwefeldichlorid
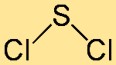
Die Struktur von Schwefelchlorid lässt sich am besten als gekrümmtes oder V-förmiges Molekül beschreiben. Es besteht aus einem zentralen Schwefelatom, an das zwei Chloratome gebunden sind. Die Anordnung der Atome und ihre Bindungswinkel tragen zur Gesamtstabilität und Reaktivität der Verbindung bei.
Löslichkeit von Schwefeldichlorid
Schwefelchlorid ist in Wasser nur begrenzt löslich. Es ist schwer löslich und neigt dazu, beim Mischen mit Wasser eine trübe Lösung zu bilden. Die Löslichkeitseigenschaften der Verbindung müssen unbedingt berücksichtigt werden, wenn ihre Kompatibilität mit anderen Substanzen und ihr Verhalten in verschiedenen Lösungsmitteln bestimmt werden.
| Aussehen | Gelbe Flüssigkeit |
| Spezifisches Gewicht | 1,64 g/ml |
| Farbe | GELB |
| Geruch | Acre |
| Molmasse | 102,91 g/Mol |
| Dichte | 1,64 g/ml |
| Fusionspunkt | -76,8°C |
| Siedepunkt | 138,8°C |
| Blitzpunkt | Nicht verfügbar |
| Löslichkeit in Wasser | Reagiert |
| Löslichkeit | Löslich in Eisessig, Benzol, Brom |
| Dampfdruck | 35,4 mmHg |
| Wasserdampfdichte | 3,9 (Luft=1) |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Schwefeldichlorid
Schwefelchlorid birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es ist stark ätzend und kann bei Kontakt mit Haut, Augen oder Schleimhäuten schwere Verätzungen verursachen. Das Einatmen seiner Dämpfe kann die Atemwege reizen und Husten, Atembeschwerden und Lungenschäden verursachen. Es ist außerdem brennbar und kann sich in Gegenwart bestimmter Substanzen entzünden. Beim Arbeiten mit Schwefelchlorid ist entsprechende Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutz zu verwenden. Es ist wichtig, diese Verbindung in einem gut belüfteten Bereich zu handhaben und zu lagern, entfernt von Zündquellen und unverträglichen Materialien, um Unfälle und mögliche Schäden zu vermeiden.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Kontakt vermeiden, Schutzausrüstung tragen, in gut belüfteten Bereichen arbeiten |
| UN-Identifikationsnummern | Ein 1828 |
| HS-Code | 2812.10.00 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Schwefeldichlorid
Es gibt verschiedene Methoden zur Synthese von Schwefelchlorid. Ein gängiger Ansatz beinhaltet die Reaktion zwischen Schwefel und Chlorgas. Bei diesem Verfahren entsteht überschüssiges Chlor, wenn der Schwefel auf eine bestimmte Temperatur erhitzt wird, normalerweise etwa 200–250 °C (392–482 °F). Die Reaktion verläuft unter Bildung von Schwefelchlorid.
Eine andere Methode beinhaltet die Reaktion zwischen Thionylchlorid (SOCl₂) und Schwefel. Thionylchlorid fungiert als Chlorquelle, die mit Schwefel zu Schwefelchlorid reagiert. Diese Reaktion findet bei einer relativ niedrigeren Temperatur statt als bei der direkten Schwefel-Chlor-Methode.
Die Reaktion zwischen Sulfurylchlorid (SO₂Cl₂) und Schwefelwasserstoff (H₂S) ermöglicht die Herstellung von Schwefelchlorid. Diese Reaktion findet bei hohen Temperaturen statt und erzeugt Schwefelchlorid und andere Nebenprodukte.
Um die Sicherheit des beteiligten Personals zu gewährleisten, ist es von entscheidender Bedeutung, die Schwefelchloridsynthese in gut ausgestatteten Labors oder Industrieumgebungen durchzuführen. Aufgrund der Gefährlichkeit der Verbindung sollte das Personal entsprechende Sicherheitsvorkehrungen befolgen, einschließlich des Tragens von Schutzausrüstung und des Arbeitens in gut belüfteten Bereichen.
Die Wahl der Synthesemethode hängt von verschiedenen Faktoren ab, darunter der Verfügbarkeit der Rohstoffe, der gewünschten Reinheit des Produkts und den spezifischen Anwendungsanforderungen. Die Auswahl der geeigneten Technik hängt von den spezifischen Anforderungen des Prozesses oder der Anwendung ab, da jede Methode ihre eigenen Vorteile und Überlegungen hat.
Verwendung von Schwefeldichlorid
Schwefelchlorid (SCl₂) findet aufgrund seiner spezifischen Eigenschaften Anwendung in verschiedenen Industrien und Prozessen. Hier sind einige wichtige Verwendungszwecke von Schwefelchlorid:
- Farbstoffherstellung: Hersteller verwenden Schwefelchlorid zur Herstellung von Farbstoffen, insbesondere Schwefelfarbstoffen, die Stoffen in der Textilindustrie leuchtende Farben verleihen.
- Gummiindustrie: Die Gummiindustrie verwendet SCl₂ als Vulkanisationsmittel, um die Festigkeit und Elastizität von Gummiprodukten durch Vernetzung von Polymerketten zu verbessern.
- Synthese von Pestiziden: Schwefelchlorid spielt eine entscheidende Rolle bei der Synthese bestimmter Pestizide und ermöglicht die Produktion von Insektiziden und Fungiziden, sogenannten Organophosphatverbindungen und Organothiophosphaten.
- Chemische Synthese: SCl₂ dient als vielseitiges Reagens in verschiedenen chemischen Reaktionen und ermöglicht Chlorierungsreaktionen wie die Umwandlung von Alkoholen in Alkylchloride oder die Synthese chlorierter organischer Verbindungen.
- Laborreagenz: Labore verwenden Schwefelchlorid als Reagenz für verschiedene Anwendungen, einschließlich organischer Synthese, Schwefelchemie und anorganischer Reaktionen.
- Wasseraufbereitung: Wasseraufbereitungsprozesse nutzen SCl₂ als Desinfektionsmittel und Oxidationsmittel, um schädliche Mikroorganismen und organische Schadstoffe aus Wasserquellen zu entfernen.
- Pharmazeutische Industrie: Schwefelchlorid findet Anwendung in der pharmazeutischen Forschung und Entwicklung, insbesondere bei der Synthese bestimmter pharmazeutischer Wirkstoffe (API).
- Chemische Analyse: Analytische Chemietechniken wie die Gaschromatographie verwenden SCl₂ zum Nachweis und zur Analyse spezifischer Verbindungen.
Diese verschiedenen Anwendungen unterstreichen die Bedeutung von Schwefelchlorid in verschiedenen industriellen Prozessen und wissenschaftlichen Unternehmungen. Aufgrund seiner Gefährlichkeit ist es jedoch wichtig, Schwefelchlorid vorsichtig zu handhaben und zu verwenden und die entsprechenden Sicherheitsrichtlinien und -verfahren einzuhalten.
Fragen:
F: Wie lautet die Formel für Schwefeldichlorid?
A: Die Formel für Schwefelchlorid lautet SCl₂.
F: Welche Formel stellt die molekulare Verbindung Schwefeldichlorid dar?
A: Die molekulare Verbindung Schwefelchlorid wird durch die Formel SCl₂ dargestellt.
F: Ist Schwefeldichlorid polar?
A: Ja, Schwefelchlorid ist aufgrund der gekrümmten Molekülgeometrie und der ungleichmäßigen Elektronendichteverteilung polar.
F: Welche Atom- oder Hybridorbitale bilden die Sigma-Bindung zwischen S und Cl in Schwefeldichlorid, SCl₂?
A: Die Sigma-Bindung zwischen Schwefel (S) und Chlor (Cl) in Schwefelchlorid (SCl₂) wird durch die Überlappung des 3p-Orbitals von Schwefel und des 3p-Orbitals von Chlor gebildet.
F: Ist SCl₂ linear?
A: Nein, Schwefelchlorid (SCl₂) ist nicht linear. Es hat eine gekrümmte oder V-förmige Molekülgeometrie.
F: Welche der folgenden Verbindungen ist eine ionische Verbindung? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
A: Keine der aufgeführten Verbindungen sind ionische Verbindungen. Hierbei handelt es sich entweder um molekulare Verbindungen (Cl₂O, CH₂O, SCl₂, PF₅) oder um eine anorganische Phosphatverbindung (Mg₃(PO₄)₂).
F: Wie heißt die Verbindung mit der Formel SCl₂?
A: Die Verbindung mit der Formel SCl₂ heißt Schwefelchlorid.
F: Welche Form hat SCl₂?
A: SCl₂ hat eine gekrümmte oder V-förmige Molekülform.
F: Wie ist die Molekülgeometrie von SCl₂?
A: Die Molekülgeometrie von SCl₂ ist gekrümmt oder V-förmig.
F: Wie heißen die Hybridorbitale, die Schwefel in SCl₂ verwendet?
A: Das Schwefelatom in SCl₂ verwendet sp²-Hybridorbitale.
F: Was passiert, wenn sich ein Schwefelatom mit zwei Chloratomen verbindet, um SCl₂ zu erzeugen?
A: Wenn sich ein Schwefelatom mit zwei Chloratomen verbindet, bildet es die Verbindung SCl₂, bekannt als Schwefelchlorid. Das Schwefelatom teilt Elektronen mit den Chloratomen, um eine kovalente Bindung zwischen ihnen herzustellen.
