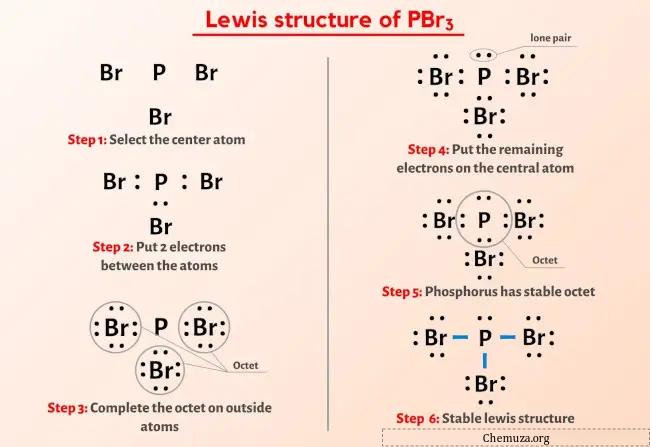
Sie haben das Bild oben also schon gesehen, oder?
Lassen Sie mich das obige Bild kurz erläutern.
Die PBr3-Lewis-Struktur hat ein Phosphoratom (P) im Zentrum, das von drei Bromatomen (Br) umgeben ist. Zwischen dem Phosphoratom (P) und jedem Bromatom (Br) bestehen drei Einfachbindungen. Es gibt ein freies Elektronenpaar am Phosphoratom (P) und drei freie Elektronenpaare an den drei Bromatomen (Br).
Wenn Sie aus dem obigen Bild der Lewis-Struktur von PBr3 nichts verstanden haben, dann bleiben Sie bei mir und Sie erhalten eine detaillierte Schritt-für-Schritt-Erklärung zum Zeichnen einer Lewis-Struktur von PBr3 .
Fahren wir also mit den Schritten zum Zeichnen der Lewis-Struktur von PBr3 fort.
Schritte zum Zeichnen der PBr3-Lewis-Struktur
Schritt 1: Ermitteln Sie die Gesamtzahl der Valenzelektronen im PBr3-Molekül
Um die Gesamtzahl der Valenzelektronen in einem PBr3- Molekül zu ermitteln, müssen Sie zunächst die im Phosphoratom und im Bromatom vorhandenen Valenzelektronen kennen.
(Valenzelektronen sind die Elektronen, die sich in der äußersten Umlaufbahn eines Atoms befinden.)
Hier erkläre ich Ihnen, wie Sie mithilfe eines Periodensystems ganz einfach die Valenzelektronen von Phosphor und Brom finden.
Gesamtvalenzelektronen im PBr3-Molekül
→ Vom Phosphoratom gegebene Valenzelektronen:
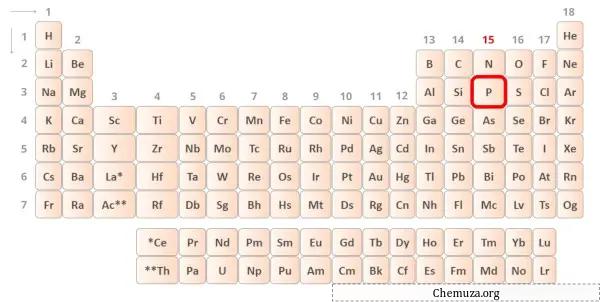
Phosphor ist ein Element der 15. Gruppe des Periodensystems. [1] Daher sind in Phosphor 5 Valenzelektronen vorhanden.

Sie können die 5 Valenzelektronen im Phosphoratom sehen, wie im Bild oben gezeigt.
→ Vom Bromatom gegebene Valenzelektronen:
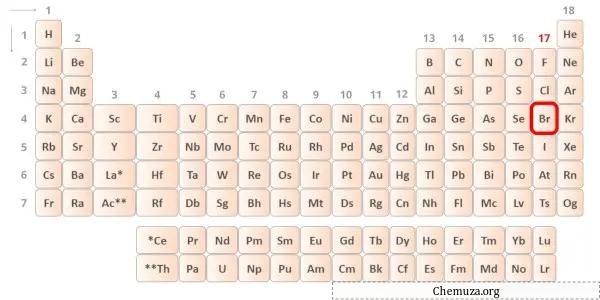
Brom ist ein Element der Gruppe 17 des Periodensystems. [2] Daher sind in Brom 7 Valenzelektronen vorhanden.
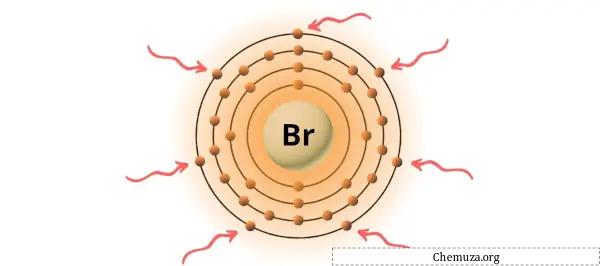
Sie können die 7 Valenzelektronen im Bromatom sehen, wie im Bild oben gezeigt.
Also,
Gesamte Valenzelektronen im PBr3-Molekül = von 1 Phosphoratom gespendete Valenzelektronen + von 3 Bromatomen gespendete Valenzelektronen = 5 + 7(3) = 26 .
Schritt 2: Wählen Sie das Zentralatom aus
Um das Zentralatom auszuwählen, müssen wir bedenken, dass das am wenigsten elektronegative Atom im Zentrum verbleibt.
Hier ist das gegebene Molekül PBr3 (Phosphortribromid) und es enthält Phosphoratome (P) und Bromatome (Br).
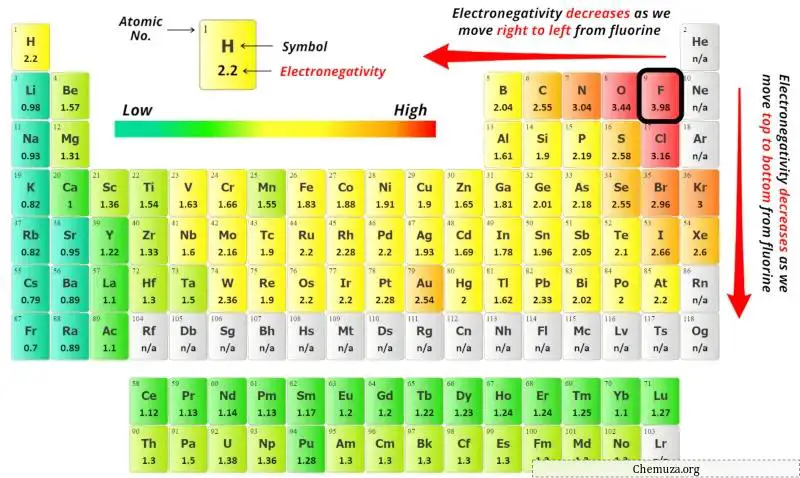
Sie können die Elektronegativitätswerte des Phosphoratoms (P) und des Bromatoms (Br) im obigen Periodensystem sehen.
Wenn wir die Elektronegativitätswerte von Phosphor (P) und Brom (Br) vergleichen, dann ist das Phosphoratom weniger elektronegativ .
Dabei ist das Phosphoratom (P) das Zentralatom und die Bromatome (Br) die Außenatome.
Schritt 3: Verbinden Sie jedes Atom, indem Sie ein Elektronenpaar zwischen ihnen platzieren
Nun müssen Sie im PBr3-Molekül die Elektronenpaare zwischen dem Phosphoratom (P) und den Bromatomen (Br) platzieren.
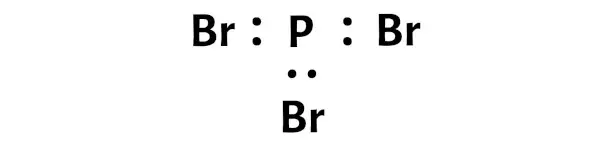
Dies weist darauf hin, dass Phosphor (P) und Brom (Br) in einem PBr3-Molekül chemisch aneinander gebunden sind.
Schritt 4: Machen Sie die externen Atome stabil. Platzieren Sie das verbleibende Valenzelektronenpaar auf dem Zentralatom.
In diesem Schritt müssen Sie die Stabilität der externen Atome überprüfen.
Hier im Diagramm des PBr3-Moleküls sieht man, dass die äußeren Atome Bromatome sind.
Diese externen Bromatome bilden ein Oktett und sind daher stabil.
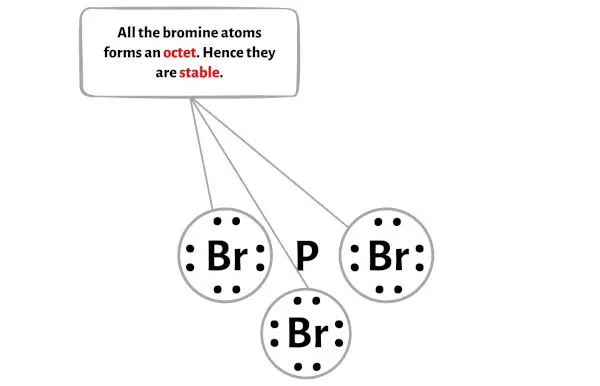
Zusätzlich haben wir in Schritt 1 die Gesamtzahl der im PBr3-Molekül vorhandenen Valenzelektronen berechnet.
Das PBr3-Molekül verfügt über insgesamt 26 Valenzelektronen , von denen im obigen Diagramm nur 24 Valenzelektronen verwendet werden.
Die Anzahl der verbleibenden Elektronen beträgt also 26 – 24 = 2 .
Sie müssen diese beiden Elektronen auf dem zentralen Phosphoratom im Diagramm oben des PBr3-Moleküls platzieren.
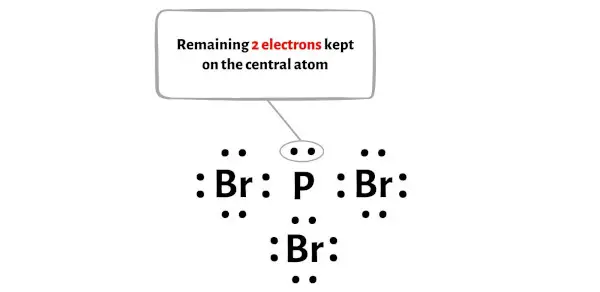
Kommen wir nun zum nächsten Schritt.
Schritt 5: Überprüfen Sie das Oktett am Zentralatom
In diesem Schritt müssen Sie prüfen, ob das zentrale Phosphoratom (P) stabil ist oder nicht.
Um die Stabilität des zentralen Phosphoratoms (P) zu überprüfen, müssen wir prüfen, ob es ein Oktett bildet oder nicht.
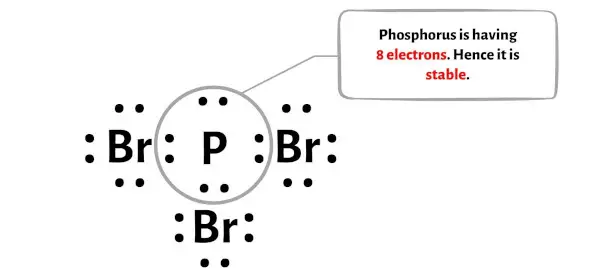
Im Bild oben sehen Sie, dass das Phosphoratom ein Oktett bildet. Das heißt, es hat 8 Elektronen.
Und deshalb ist das zentrale Phosphoratom stabil.
Kommen wir nun zum letzten Schritt, um zu überprüfen, ob die Lewis-Struktur von PBr3 stabil ist oder nicht.
Schritt 6: Überprüfen Sie die Stabilität der Lewis-Struktur
Jetzt sind Sie beim letzten Schritt angelangt, in dem Sie die Stabilität der Lewis-Struktur von PBr3 überprüfen müssen.
Die Stabilität der Lewis-Struktur kann mithilfe eines formalen Ladungskonzepts überprüft werden.
Kurz gesagt, wir müssen nun die formale Ladung der im PBr3-Molekül vorhandenen Phosphoratome (P) und Bromatome (Br) ermitteln.
Um die formelle Steuer zu berechnen, müssen Sie die folgende Formel verwenden:
Formale Ladung = Valenzelektronen – (bindende Elektronen)/2 – nichtbindende Elektronen
Im Bild unten können Sie die Anzahl der bindenden und nichtbindenden Elektronen für jedes Atom des PBr3-Moleküls sehen.
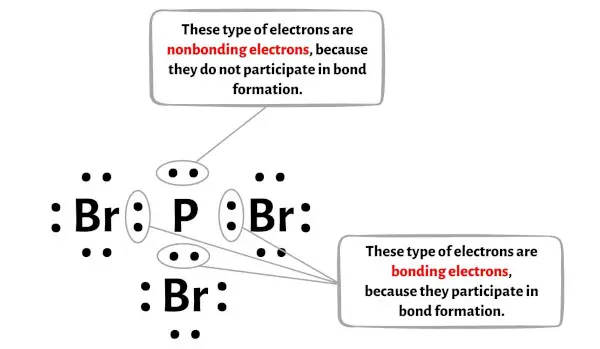
Für das Phosphoratom (P):
Valenzelektronen = 5 (da Phosphor in Gruppe 15 ist)
Bindungselektronen = 6
Nichtbindende Elektronen = 2
Für das Bromatom (Br):
Valenzelektronen = 7 (da Brom in Gruppe 17 ist)
Bindungselektronen = 2
Nichtbindende Elektronen = 6
| Formelle Anklage | = | Valenzelektronen | – | (Bindungselektronen)/2 | – | Nichtbindende Elektronen | ||
| P. | = | 5 | – | 6/2 | – | 2 | = | 0 |
| Br | = | 7 | – | 2/2 | – | 6 | = | 0 |
Aus den obigen formalen Ladungsberechnungen können Sie ersehen, dass sowohl das Phosphoratom (P) als auch das Bromatom (Br) eine formale Ladung von „Null“ haben.
Dies weist darauf hin, dass die obige Lewis-Struktur von PBr3 stabil ist und es keine weitere Änderung in der obigen Struktur von PBr3 gibt.
In der obigen Lewis-Punkt-Struktur von PBr3 können Sie jedes Bindungselektronenpaar (:) auch als Einfachbindung (|) darstellen. Dies führt zu der folgenden Lewis-Struktur von PBr3.
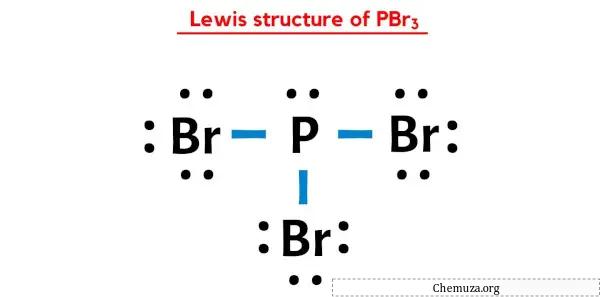
Ich hoffe, Sie haben alle oben genannten Schritte vollständig verstanden.
Für mehr Übung und ein besseres Verständnis können Sie andere unten aufgeführte Lewis-Strukturen ausprobieren.
Probieren Sie zum besseren Verständnis diese Lewis-Strukturen aus (oder sehen Sie sie sich zumindest an):
