Eisen(III)-chlorid ist eine Verbindung, die durch die Verbindung von Eisen und Chlor entsteht. Es wird als Katalysator, bei der Wasseraufbereitung und als Reagens bei chemischen Reaktionen eingesetzt.
| IUPAC-Name | Eisen(III)-chlorid |
| Molekularformel | FeCl₃ |
| CAS-Nummer | 7705-08-0 |
| Synonyme | Eisenchlorid, Eisentrichlorid, Trichlorfer |
| InChI | InChI=1S/ClH.3Fe/h1H;;;/q;;3*+3/p-3 |
Eigenschaften von Eisen(III)-chlorid
Formel für Eisen(III)-chlorid
Die Formel für Eisentrichlorid lautet FeCl₃. Es stellt die Kombination aus einem Eisenatom (Fe) und drei Chloratomen (Cl) dar. Diese Formel gibt das stöchiometrische Verhältnis jedes Elements in der Verbindung an.
Molmasse von Eisen(III)-chlorid
Die Molmasse von Eisentrichlorid wird durch Addition der Atommassen aller seiner Bestandteile berechnet. Eisen hat eine Atommasse von 55.845 g/mol, während Chlor eine Atommasse von 35.453 g/mol hat. Die Multiplikation der Atommasse von Eisen mit eins und der Atommasse von Chlor mit drei ergibt eine Molmasse von 162,204 g/mol für Eisentrichlorid.
Siedepunkt von Eisen(III)-chlorid
Eisentrichlorid hat einen Siedepunkt von etwa 315 °C (599 °F). Bei dieser Temperatur vollzieht die Verbindung einen Phasenübergang vom flüssigen zum gasförmigen Zustand. Der Siedepunkt ist ein Maß für den Dampfdruck, den ein Stoff ausübt, wenn seine Temperatur einen bestimmten Wert erreicht.
Schmelzpunkt von Eisen(III)-chlorid
Der Schmelzpunkt von Eisentrichlorid liegt bei etwa 306 °C (583 °F). Diese Temperatur stellt den Punkt dar, an dem die feste Verbindung in eine Flüssigkeit übergeht. Der Schmelzpunkt ist eine charakteristische Eigenschaft eines Stoffes und ermöglicht dessen Identifizierung.
Dichte von Eisen(III)-chlorid g/ml
Die Dichte von Eisentrichlorid beträgt etwa 2,90 g/ml. Die Dichte ist definiert als die Masse eines Stoffes pro Volumeneinheit. Die Dichte von Eisentrichlorid weist darauf hin, dass es sich um eine relativ dichte Verbindung handelt.
Molekulargewicht von Eisen(III)-chlorid
Das Molekulargewicht von Eisentrichlorid wird durch Addition der Atomgewichte seiner Bestandteile berechnet. Bei einem Eisenatom mit einem Gewicht von 55,845 g/mol und drei Chloratomen mit einem Gewicht von jeweils 35,453 g/mol beträgt das Molekulargewicht von Eisentrichlorid 162,204 g/mol.
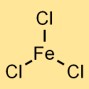
Struktur von Eisen(III)-chlorid
Eisentrichlorid hat eine Kristallgitterstruktur. Es bildet eine Ionenbindung, wobei das Eisenatom (Fe³⁺) drei Chlorionen (Cl⁻) anzieht. Die resultierende Verbindung nimmt eine Kristallanordnung an, in der positiv geladene Eisenionen von negativ geladenen Chloridionen umgeben sind.
Löslichkeit von Eisen(III)-chlorid
Eisentrichlorid ist in Wasser, Ethanol und anderen polaren Lösungsmitteln löslich. Wenn es in Wasser gelöst wird, dissoziiert es und bildet Fe³⁺-Kationen und Cl⁻-Anionen. Die Löslichkeit von Eisentrichlorid in Wasser wird durch Faktoren wie Temperatur und Konzentration beeinflusst, wobei höhere Temperaturen und Konzentrationen zu einer erhöhten Löslichkeit führen.
| Aussehen | Gelbbrauner Feststoff |
| Spezifisches Gewicht | 2,90 g/ml |
| Farbe | Gelb Braun |
| Geruch | Geruchlos |
| Molmasse | 162.204 g/Mol |
| Dichte | 2,90 g/ml |
| Fusionspunkt | 306 °C (583 °F) |
| Siedepunkt | 315 °C (599 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich, beeinflusst durch Faktoren wie Temperatur und Konzentration |
| Löslichkeit | Löslich in polaren Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Säure (ca. 2) |
Sicherheit und Gefahren von Eisen(III)-chlorid
Eisentrichlorid birgt bestimmte Sicherheitsaspekte und Gefahren. Es ist ätzend und kann schwere Haut- und Augenreizungen verursachen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Es ist wichtig, mit dieser Verbindung vorsichtig umzugehen und geeignete Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Vermeiden Sie direkten Kontakt und Einatmen der Substanz. Bei Haut- oder Augenkontakt mit viel Wasser ausspülen und ggf. einen Arzt aufsuchen. Eisentrichlorid sollte in einem dicht verschlossenen Behälter, fern von unverträglichen Substanzen, aufbewahrt werden. Befolgen Sie die ordnungsgemäßen Entsorgungsverfahren, um eine Umweltverschmutzung zu vermeiden.
| Gefahrensymbole | Ätzend (C) |
| Sicherheitsbeschreibung | Verursacht schwere Hautverbrennungen und Augenschäden. |
| UN-Identifikationsnummern | UN3264 |
| HS-Code | 2827.39.60 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Mäßig giftig für den Menschen |
Methoden zur Synthese von Eisen(III)-chlorid
Es gibt verschiedene Methoden zur Synthese von Eisentrichlorid.
Eine übliche Methode beinhaltet die Reaktion zwischen Eisen und Chlorgas . In einer kontrollierten Umgebung wie einem Reaktor verbinden sich Eisenspäne oder Eisenpulver mit Chlorgas bei hohen Temperaturen, normalerweise etwa 300 bis 500 °C (572 bis 932 °F), ausgelöst durch das Erhitzen der Mischung. Eisen reagiert mit Chlor , es entsteht Eisentrichlorid.
Eine andere Methode beinhaltet die Reaktion zwischen Eisenoxid, normalerweise Eisen(III)-oxid (Fe₂O₃), und Salzsäure (HCl) . Um die Reaktion zu fördern, löst Salzsäure das Eisenoxid und erhitzt die Mischung. Im weiteren Verlauf der Reaktion entsteht Eisentrichlorid unter Freisetzung von Wasser.
Die Gewinnung von Eisentrichlorid ist auch durch die direkte Reaktion von Eisen mit konzentrierter Salzsäure möglich. Die Zugabe von Eisen zur sauren Lösung löst die Reaktion aus, die unter Freisetzung von Wasserstoffgas fortgesetzt wird. Das Erhitzen der resultierenden Mischung erleichtert die Umwandlung von Eisen in Eisentrichlorid.
Es ist wichtig zu beachten, dass diese Synthesemethoden unter angemessenen Sicherheitsvorkehrungen und in gut belüfteten Bereichen durchgeführt werden sollten, da bei einigen Reaktionen ätzende Substanzen verwendet werden und giftige Gase entstehen.
Verwendung von Eisen(III)chlorid
Aufgrund seiner vielseitigen Eigenschaften findet Eisentrichlorid in verschiedenen Bereichen Anwendung. Hier sind einige häufige Verwendungszwecke:
- Wasseraufbereitung: Bei der Koagulation in Wasseraufbereitungsprozessen wird häufig Eisentrichlorid verwendet, um Verunreinigungen und Schwebstoffe zu entfernen und so Wasser zum Trinken geeignet zu machen.
- Ätzmittel: Die Elektronikindustrie verwendet Eisentrichlorid als Ätzmittel zur Herstellung von Leiterplatten, zum selektiven Ätzen von Kupfer und zur Erstellung von Schaltkreisdesigns.
- Katalysator: Eisentrichlorid katalysiert verschiedene chemische Reaktionen, darunter die Synthese organischer Verbindungen und die Chlorierung aromatischer Verbindungen.
- Pigmentherstellung: Bei der Herstellung verschiedener Pigmente wie Eisenblau und Toner für Druckfarben wird Eisentrichlorid verwendet.
- Farbstoffherstellung: Bei der Synthese von Farbstoffen, insbesondere zum Färben von Textilien, Leder und Papier, wird Eisentrichlorid verwendet.
- Oberflächenbehandlung von Metallen: Zur Verbesserung der Korrosionsbeständigkeit von Metallen wie Aluminium und Edelstahl wird Eisentrichlorid als Oberflächenbehandlungsmittel verwendet.
- Laborreagenz: Eisentrichlorid wird häufig als Laborreagenz für verschiedene analytische und synthetische Zwecke verwendet.
- Medizinische Anwendungen: Bei der Herstellung einiger pharmazeutischer Produkte, wie z. B. Eisenpräparaten und Medikamenten zur Behandlung von Anämie, wird Eisentrichlorid medizinisch verwendet.
- Fotografie: Eisentrichlorid dient als Tönungsmittel in fotografischen Prozessen und erzeugt Sepiatöne in der Schwarzweißfotografie.
- Textilindustrie: Beim Beizen und Färben von Stoffen in der Textilindustrie wird Eisentrichlorid verwendet, um die Farbechtheit und Farbstoffaufnahme zu verbessern.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Eisentrichlorid in verschiedenen Industrien und wissenschaftlichen Bereichen.
Fragen:
F: Wie groß ist die Molmasse von Eisen(III)-chlorid, FeCl₃?
A: Die Molmasse von Eisentrichlorid beträgt 162,204 g/mol.
F: Wie viele Eisenatome enthält eine Formeleinheit Eisen(III)-chlorid?
A: Eine Formeleinheit Eisentrichlorid enthält ein Atom Eisen.
F: Wie lautet die Formel für Eisen(III)-chlorid?
A: Die Formel für Eisentrichlorid lautet FeCl₃.
F: Wie hoch ist die Massenprozentzusammensetzung von Eisen in Eisen(III)-chlorid?
A: Die Massenprozentzusammensetzung von Eisen in Eisentrichlorid beträgt etwa 34,8 %.
F: Wie lautet die Formel für Eisen(III)-chlorid?
A: Die Formel für Eisentrichlorid lautet FeCl₃.
F: Wie groß ist die Molmasse von Eisen(III)-chlorid?
A: Die Molmasse von Eisentrichlorid beträgt 162,204 g/mol.
F: Wie stellt man Eisen(III)-chlorid her?
A: Eisentrichlorid kann durch Reaktion von Eisen mit Chlorgas oder durch Auflösen von Eisenoxid in Salzsäure hergestellt werden.
F: Ist Eisen(III)-chlorid sauer?
A: Ja, Eisentrichlorid ist sauer und kann den pH-Wert einer Lösung senken.
F: Welche Produkte entstehen bei der Reaktion zwischen metallischem Zink und Eisen(III)-chlorid?
A: Die Reaktion zwischen metallischem Zink und Eisentrichlorid erzeugt Zinkchlorid und metallisches Eisen.
F: Ist Eisen(III)-chlorid giftig?
A: Eisentrichlorid ist für den Menschen mäßig giftig und kann Haut- und Augenreizungen verursachen.
F: Ist Eisen(III)-chlorid schädlich für die Umwelt?
A: Eisentrichlorid kann schädlich für die Umwelt sein, wenn es in großen Mengen freigesetzt wird, da es Wasserquellen verunreinigen und das Leben im Wasser beeinträchtigen kann.
F: Wie entferne ich Eisen(III)-chlorid?
A: Eisentrichlorid muss gemäß den örtlichen Vorschriften zur Entsorgung gefährlicher Abfälle ordnungsgemäß entsorgt werden. Bitten Sie die zuständigen Behörden um Rat.
F: Wie groß ist die Molmasse von Eisen(III)-chlorid?
A: Die Molmasse von Eisentrichlorid beträgt 162,204 g/mol.
