Propionsäureanhydrid ist eine chemische Verbindung, die bei der Synthese verschiedener Arzneimittel, Farbstoffe und Pestizide verwendet wird. Es fungiert als Acylierungsreagenz bei organischen Reaktionen.
| IUPAC-Name | Propansäureanhydrid |
| Molekularformel | C6H10O3 |
| CAS-Nummer | 123-62-6 |
| Synonyme | Propionsäureanhydrid, Propionylanhydrid, Ethylformanhydrid, Propanoyloxid |
| InChI | InChI=1S/C6H10O3/c1-2-5-8-6(7)9-3-4-8/h1-4H2 |
Eigenschaften von Propionsäureanhydrid
Propionsäureanhydrid-Formel
Die Formel für Propionylanhydrid lautet C6H10O3. Es stellt die chemische Zusammensetzung dieser Verbindung dar und zeigt die Art und Anzahl der in jedem Molekül vorhandenen Atome.
Molmasse von Propionsäureanhydrid
Die Molmasse von Propionylanhydrid ist die Summe der Atommassen aller seiner Atombestandteile. Mit der Summenformel C6H10O3 errechnet sich seine Molmasse zu etwa 130,14 g/mol.
Siedepunkt von Propionsäureanhydrid
Propionylanhydrid hat einen Siedepunkt von etwa 169–170 °C (336–338 °F). Diese Temperatur gibt den Punkt an, an dem die Verbindung unter normalem Atmosphärendruck von einer Flüssigkeit in ein Gas übergeht.
Propionsäureanhydrid Schmelzpunkt
Der Schmelzpunkt von Propionylanhydrid liegt bei etwa -42 bis -41 °C (-44 bis -42 °F). Dies ist die Temperatur, bei der die Verbindung vom festen in den flüssigen Zustand übergeht.
Dichte von Propionsäureanhydrid g/ml
Propionylanhydrid hat eine Dichte von etwa 1,08 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar und gibt damit ihre Schwere oder Kompaktheit an.
Molekulargewicht von Propionsäureanhydrid
Das Molekulargewicht von Propionylanhydrid wird mit etwa 126,11 g/mol berechnet. Es ist die Summe der Atomgewichte aller Atome in einem einzelnen Molekül der Verbindung.
Struktur von Propionsäureanhydrid
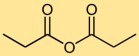
Die Struktur von Propionylanhydrid besteht aus einem zentralen Kohlenstoffatom, das an zwei Sauerstoffatome und zwei zusätzliche Kohlenstoffatome gebunden ist. Es entsteht durch die Kondensation zweier Propionsäuremoleküle.
Löslichkeit von Propionsäureanhydrid
Propionylanhydrid ist in Wasser schlecht löslich. Es weist eine bessere Löslichkeit in organischen Lösungsmitteln wie Ether, Benzol und Chloroform auf. Die Löslichkeitseigenschaften der Verbindung sind wichtige Faktoren, die bei verschiedenen Anwendungen und chemischen Reaktionen berücksichtigt werden müssen.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,08 g/ml |
| Farbe | N / A |
| Geruch | Würzig, scharf |
| Molmasse | 130,14 g/Mol |
| Dichte | 1,08 g/ml |
| Fusionspunkt | -42 bis -41 °C (-44 bis -42 °F) |
| Siedepunkt | 169–170 °C (336–338 °F) |
| Blitzpunkt | 64°C (147°F) |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Ether, Benzol und Chloroform |
| Dampfdruck | 1,4 mmHg bei 25°C |
| Wasserdampfdichte | 4,4 (Luft = 1) |
| pKa | 4,85 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Propionsäureanhydrid
Propionylanhydrid birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es reizt Augen, Haut und Atemwege. Direkter Kontakt kann zu Verbrennungen oder chemischer Sensibilisierung führen. Das Einatmen von Dämpfen kann zu Reizungen der Atemwege und Atembeschwerden führen. Die Verbindung ist brennbar und kann mit Luft explosionsfähige Gemische bilden. Bei der Arbeit mit Propionylanhydrid sollte für ausreichende Belüftung und Schutzausrüstung wie Handschuhe und Schutzbrillen gesorgt werden. Bei Verschlucken sollte sofort ein Arzt aufgesucht werden. Um die mit dieser Chemikalie verbundenen Risiken zu minimieren, sollten ordnungsgemäße Lagerungs- und Handhabungsverfahren befolgt werden.
| Gefahrensymbole | Ätzend (C) |
| Sicherheitsbeschreibung | Von Hitze, Funken, offenen Flammen und heißen Oberflächen fernhalten. Vermeiden Sie das Einatmen von Dämpfen oder Nebel. Schutzhandschuhe, Augen-/Gesichtsschutz und Schutzkleidung tragen. |
| UN-Identifikationsnummern | UN 2924 |
| HS-Code | 29159010 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Gesundheitsschädlich beim Verschlucken oder Einatmen. Verursacht schwere Hautverbrennungen und Augenschäden. |
Methoden zur Synthese von Propionsäureanhydrid
Mehrere Methoden ermöglichen die Synthese von Propionylanhydrid.
Ein gängiger Ansatz ist die Reaktion zwischen Propansäure und Essigsäureanhydrid . Bei dieser Methode fungiert Propansäure als Reaktant und reagiert mit Essigsäureanhydrid in Gegenwart eines Katalysators wie Schwefelsäure oder p-Toluolsulfonsäure. Die Reaktion verläuft über einen Veresterungsprozess, der zur Bildung von Propionylanhydrid und Essigsäure als Nebenprodukt führt.
Eine andere Methode beinhaltet die Reaktion von Propansäure mit Phthalsäureanhydrid. Diese Reaktion findet unter Rückflussbedingungen in Gegenwart eines Katalysators wie konzentrierter Schwefelsäure oder Zinkchlorid statt. Bei der Reaktion entstehen Propionylanhydrid und Phthalsäure als Nebenprodukt.
Ein alternativer Syntheseweg nutzt die Reaktion zwischen Propionsäure und Acetylchlorid . Diese Reaktion findet unter kontrollierten Bedingungen in Gegenwart eines Lewis-Säure-Katalysators wie Aluminiumchlorid oder Zinkchlorid statt. Die resultierende Reaktion ergibt Propionylanhydrid und Salzsäure.
Diese Verfahren ermöglichen die Herstellung von Propionylanhydrid im Labor- oder Industriemaßstab. Es ist wichtig zu bedenken, dass Einzelpersonen bei der Synthese von Propionylanhydrid Sicherheitsvorkehrungen und ordnungsgemäße Handhabungsverfahren befolgen müssen, da die beteiligten Reagenzien und Katalysatoren gefährlich sind.
Verwendung von Propionsäureanhydrid
Propionylanhydrid findet aufgrund seiner vielseitigen Eigenschaften vielfältige Anwendungsmöglichkeiten. Zu den wichtigsten Einsatzmöglichkeiten gehören:
- Pharmazeutische Industrie: Es dient als entscheidendes Zwischenprodukt bei der Synthese pharmazeutischer Verbindungen, darunter Analgetika, Antibiotika und Entzündungshemmer.
- Textilindustrie: Die Textilindustrie verwendet Propionylanhydrid für die Textilverarbeitung, insbesondere bei der Herstellung synthetischer Fasern.
- Agrochemikalien: Propionylanhydrid spielt eine wesentliche Rolle bei der Herstellung von Pestiziden und Herbiziden und trägt zum Pflanzenschutz und zur Schädlingsbekämpfung bei.
- Polymerindustrie: Propionylanhydrid fungiert als Acylierungsmittel und ist an der Synthese von Polymeren, Harzen und Beschichtungen beteiligt.
- Chemische Forschung: Es dient als Reagens bei verschiedenen organischen Reaktionen und ermöglicht die Bildung von Estern und anderen Derivaten.
- Lösungsmittelanwendungen: Propionylanhydrid wird als Lösungsmittel für Cellulosederivate, Harze und Wachse verwendet.
- Duft- und Geschmacksindustrie: Sie trägt zur Schaffung von Duft- und Geschmacksstoffen bei und verbessert die Duft- und Geschmacksprofile verschiedener Produkte.
- Farbstoffherstellung: Hersteller verwenden Propionylanhydrid bei der Herstellung von Farbstoffen, insbesondere zur Synthese von Säurefarbstoffen und Reaktivfarbstoffen.
- Laborreagenz: Es dient als wertvolles Laborreagenz für die organische Synthese und Analyse.
Diese Anwendungen unterstreichen die Bedeutung von Propionylanhydrid in zahlreichen Branchen und tragen zur Entwicklung von Pharmazeutika, Agrochemikalien, Polymeren usw. bei.
Fragen:
F: Wie schnell verläuft die Hydrolyse von Propionsäureanhydrid in Säure?
A: Die Hydrolyse von Propionylanhydrid in Säure verläuft relativ schnell, wobei die Reaktion mit einer angemessenen Geschwindigkeit abläuft.
F: Ist Propionsäureanhydrid reizend?
A: Ja, Propionylanhydrid ist reizend und verursacht bei direktem Kontakt Reizungen der Augen, der Haut und der Atemwege.
F: Welche Struktur hat Propionessigsäureanhydrid?
A: Propionylessigsäureanhydrid hat eine Struktur, die aus zwei Acylgruppen besteht, die an ein zentrales Sauerstoffatom gebunden sind.
F: Wie stellt man Propionsäureanhydrid her?
A: Propionylanhydrid kann durch Reaktion von Propionsäure mit einem geeigneten Acylierungsmittel wie Essigsäureanhydrid oder Acetylchlorid synthetisiert werden.
F: Was ist das Produkt der folgenden Reaktion: Propionsäureanhydrid?
A: Das Reaktionsprodukt, an dem Propionylanhydrid beteiligt ist, hängt von den spezifischen Reaktionsbedingungen und den beteiligten Reaktanten ab.
F: Wie schnell verläuft die Hydrolyse von Propionsäureanhydrid in Säure?
A: Die Hydrolyse von Propionylanhydrid in Säure erfolgt relativ schnell.
F: Wie zeichnet man die Linienwinkelformel für Propionessigsäureanhydrid?
A: Die Linienwinkelformel für Propionylessigsäureanhydrid kann erstellt werden, indem man die Atome als Eckpunkte darstellt und sie entsprechend der Anordnung der Bindungen mit Linien verbindet.
F: Ist Propionsäureanhydrid polar?
A: Ja, Propionylanhydrid ist aufgrund der Anwesenheit polarer Bindungen und der asymmetrischen Ladungsverteilung innerhalb des Moleküls polar.
