Natriumdichromat ist eine chemische Verbindung. Es ist ein Oxidationsmittel und eine hochgiftige Substanz. Es wird in verschiedenen industriellen Prozessen eingesetzt, beispielsweise bei der Metallbeschichtung und der Pigmentherstellung.
| IUPAC-Name | Natriumdichromat |
| Molekularformel | Na2Cr2O7 |
| CAS-Nummer | 10588-01-9 |
| Synonyme | Natriumdichromat, Dinatriumdichromat, Natriumdichromat |
| InChI | InChI=1S/2Cr.2Na.7O/q2*+6;2*+1;7*-2 |
Eigenschaften von Natriumdichromat
Natriumdichromat-Formel
Die Formel für Natriumdichromat lautet Na2Cr2O7. Es besteht aus zwei Natriumatomen (Na), zwei Chromatomen (Cr) und sieben Sauerstoffatomen (O). Die Formel stellt das Verhältnis jedes Elements in der Verbindung dar.
Molmasse von Natriumdichromat
Die Molmasse von Natriumdichromat wird durch Addition der Atommassen aller seiner Bestandteile berechnet. Natrium (Na) hat eine Atommasse von 22,99 g/mol, Chrom (Cr) hat eine Masse von 51,99 g/mol und Sauerstoff (O) hat eine Masse von 16,00 g/mol. Addiert man diese Werte, ergibt sich für Natriumdichromat eine Molmasse von 261,97 g/mol.
Siedepunkt von Natriumdichromat
Natriumdichromat hat einen Siedepunkt von etwa 400 °C (752 °F). Dies ist die Temperatur, bei der die Verbindung beim Erhitzen unter normalem Atmosphärendruck von der flüssigen Phase in die gasförmige Phase übergeht.
Natriumdichromat Schmelzpunkt
Der Schmelzpunkt von Natriumdichromat liegt bei etwa 357 °C (675 °F). Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht. Es ist wichtig zu beachten, dass der Schmelzpunkt je nach Reinheit der Probe leicht variieren kann.
Dichte von Natriumdichromat g/ml
Die Dichte von Natriumdichromat beträgt etwa 2,52 g/ml. Die Dichte ist ein Maß für die Masse eines Stoffes pro Volumeneinheit. Im Fall von Natriumdichromat zeigt dieser Wert an, dass ein bestimmtes Volumen der Verbindung relativ schwer ist.
Molekulargewicht von Natriumdichromat
Das Molekulargewicht von Natriumdichromat beträgt 261,97 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller in einem Molekül der Verbindung vorhandenen Atome dar.
Struktur von Natriumdichromat
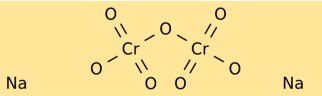
Natriumdichromat hat eine Kristallstruktur, die leuchtend rot-orangefarbene Kristalle bildet. Es besteht aus Natriumionen (Na+) und Dichromat-Ionen (Cr2O7^2-). Das Dichromat-Ion hat ein zentrales Chromatom, das auf einer Seite an zwei Sauerstoffatome und auf der anderen Seite an drei Sauerstoffatome gebunden ist.
Löslichkeit von Natriumdichromat
Natriumdichromat ist in Wasser sehr gut löslich. Es löst sich leicht in Wasser und bildet eine gelb-orange Lösung. Die Löslichkeit von Natriumdichromat in Wasser wird durch Faktoren wie Temperatur und pH-Wert beeinflusst, wobei höhere Temperaturen und niedrigere pH-Werte die Löslichkeit erhöhen.
| Aussehen | Rot-orangefarbene Kristalle |
| Spezifisches Gewicht | 2,52 |
| Farbe | Leuchtendes Rot-Orange |
| Geruch | Geruchlos |
| Molmasse | 261,97 g/Mol |
| Dichte | 2,52 g/ml |
| Fusionspunkt | 357 °C (675 °F) |
| Siedepunkt | 400 °C (752 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, schwer löslich in Ethanol/Methanol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Natriumdichromat
Natriumdichromat birgt erhebliche Sicherheitsrisiken. Es ist hochgiftig, wenn es verschluckt, eingeatmet oder über die Haut aufgenommen wird. Dies kann bei Kontakt zu schweren Verbrennungen und Augenschäden führen. Die Verbindung wird auch als potenziell krebserregend eingestuft und kann Krebs verursachen. Darüber hinaus ist es ein Oxidationsmittel, was bedeutet, dass es heftig mit brennbaren Materialien reagieren kann, was die Brand- oder Explosionsgefahr erhöht. Beim Umgang mit Natriumdichromat sollten entsprechende Sicherheitsvorkehrungen getroffen werden, einschließlich der Verwendung von Schutzkleidung, Handschuhen und Brillen. Es sollte an einem sicheren, gut belüfteten Ort fern von unverträglichen Substanzen gelagert werden. Bei Exposition oder Verschlucken ist sofortige ärztliche Hilfe von entscheidender Bedeutung.
| Gefahrensymbole | Ätzend, gesundheitsgefährdend |
| Sicherheitsbeschreibung | Sehr giftig, ätzend, krebserregend |
| UN-Identifikationsnummern | UN3086 |
| HS-Code | 28415000 |
| Gefahrenklasse | 6.1 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Natriumdichromat
Es gibt verschiedene Methoden zur Synthese von Natriumdichromat. Eine häufig verwendete Methode ist die Reaktion zwischen Natriumchromat (Na2CrO4) und Natriumdichromat (Na2Cr2O7). Schwefelsäure (H2SO4) reagiert mit Natriumchromat unter Bildung von Natriumdichromat und Wasser. Die chemische Gleichung für diese Reaktion lautet:
2Na2CrO4 + 2H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Eine andere Methode beinhaltet die Oxidation von Natriumchromat mit einem starken Oxidationsmittel wie Kaliumpermanganat (KMnO4) . Bei dieser Reaktion reagiert Natriumchromat mit Kaliumpermanganat in Gegenwart von Schwefelsäure zu Natriumdichromat, Mangandioxid (MnO2) und Wasser.
2Na2CrO4 + 6KMnO4 + 7H2SO4 → 2Na2Cr2O7 + 6MnO2 + 7K2SO4 + 8H2O
Bei der Reaktion zwischen Natriumhydroxid (NaOH) und Chromtrioxid (CrO3) entsteht Natriumdichromat. Die Reaktion findet in einem wässrigen Medium statt und erzeugt Natriumdichromat und Wasser.
2NaOH + CrO3 → Na2Cr2O7 + H2O
Bei der Umsetzung dieser synthetischen Methoden sollten Einzelpersonen aufgrund der toxischen und gefährlichen Natur von Natriumdichromat Vorsicht walten lassen. Der Einsatz geeigneter Sicherheitsmaßnahmen und Schutzausrüstung ist zwingend erforderlich, um das Wohlbefinden der am Prozess Beteiligten zu gewährleisten.
Verwendung von Natriumdichromat
Natriumdichromat findet in verschiedenen Industriezweigen vielfältige Anwendung. Hier sind einige seiner Verwendungsmöglichkeiten:
- Metallbeschichtung: Bei Galvanikverfahren wird Natriumdichromat verwendet, um eine schützende und dekorative Beschichtung auf verschiedene Metalloberflächen wie Stahl, Aluminium und Zink aufzutragen.
- Pigmentproduktion: Natriumdichromat spielt eine wichtige Rolle bei der Produktion von Pigmenten wie Chromgelb und Chromgrün, die häufig in Farben, Tinten und Farbstoffen vorkommen.
- Holzschutzmittel: Natriumdichromat schützt Holz mit seinen stark oxidierenden Eigenschaften vor Fäulnis, Insekten und Pilzen, insbesondere bei Außenanwendungen.
- Ledergerbung: Die Gerbereiindustrie verwendet Natriumdichromat als Beizmittel während des Lederbehandlungsprozesses und verbessert dadurch die Farbechtheit und Haltbarkeit des Leders.
- Chemische Synthese: Natriumdichromat fungiert als Reagens bei verschiedenen chemischen Reaktionen, einschließlich der Synthese organischer Verbindungen, Oxidationsreaktionen und der Herstellung anderer Chromverbindungen.
- Laboranwendungen: Natriumdichromat findet Laboranwendungen für analytische Tests, Kalibrierungsstandards und chemische Forschung.
- Textilindustrie: Natriumdichromat verbessert die Farbechtheit und fördert eine bessere Haftung von Farbstoffen auf Stoffen beim Färben und Bedrucken von Textilien.
- Fotografie: Natriumdichromat ist ein entscheidender Bestandteil in lichtempfindlichen Emulsionen und fungiert in einigen fotografischen Prozessen als Oxidationsmittel.
Aufgrund seiner Toxizität und Auswirkungen auf die Umwelt ist es wichtig, mit Natriumdichromat vorsichtig umzugehen und die Sicherheitshinweise und ordnungsgemäßen Entsorgungsmethoden zu beachten.
Fragen:
F: Wie viele Sauerstoffatome sind in 3,00 g Natriumdichromat, Na2Cr2O7, enthalten?
A: 3,00 g Natriumdichromat enthalten 6,02 x 10^22 Sauerstoffatome.
F: Wie viele Sauerstoffatome sind in 4,00 g Natriumdichromat, Na2Cr2O7, enthalten?
A: In 4,00 g Natriumdichromat sind 8,03 x 10^22 Sauerstoffatome enthalten.
F: Wie viele Sauerstoffatome sind in 5,00 g Natriumdichromat, Na2Cr2O7, enthalten?
A: 5,00 g Natriumdichromat enthalten 1,00 x 10^23 Sauerstoffatome.
F: Wie viele Sauerstoffatome sind in 6,00 g Natriumdichromat, Na2Cr2O7, enthalten?
A: 6,00 g Natriumdichromat enthalten 1,20 x 10^23 Sauerstoffatome.
F: Wie viele Sauerstoffatome sind in 7,00 g Natriumdichromat enthalten?
A: 7,00 g Natriumdichromat enthalten 1,40 x 10^23 Sauerstoffatome.
F: Sicherheitsdatenblatt von Natriumdichromat?
A: Das Sicherheitsdatenblatt (MSDS) für Natriumdichromat enthält detaillierte Informationen zu seinen Eigenschaften, Vorsichtsmaßnahmen bei der Handhabung und Sicherheitsmaßnahmen.
F: Was könnte Natriumdichromat ersetzen?
A: Alternativen zu Natriumdichromat sind je nach Anwendungsfall auch andere Chromverbindungen, etwa dreiwertige Chromsalze oder Nicht-Chrom-Substanzen.
F: Wofür wird Natriumdichromat verwendet?
A: Natriumdichromat wird als Oxidationsmittel, Holzschutzmittel und Pigment sowie in verschiedenen industriellen Prozessen wie Metallbeschichtung und Ledergerbung verwendet.
F: Kann eine gelbe Chromatlösung aus Natriumdichromat-Dihydrat hergestellt werden?
A: Ja, eine gelbe Chromatlösung kann durch Auflösen von Natriumdichromat-Dihydrat in Wasser hergestellt werden.
F: Wie lautet die Formel für Natriumdichromat?
A: Die Formel für Natriumdichromat lautet Na2Cr2O7.
F: Ist Natriumdichromat anorganisch?
A: Ja, Natriumdichromat ist eine anorganische Verbindung.
F: Worauf wird Natriumdichromat getestet?
A: Natriumdichromat kann zu Testzwecken verwendet werden, beispielsweise um das Vorhandensein bestimmter Substanzen zu beurteilen oder bestimmte chemische Reaktionen zu überwachen.
