Chromtrioxid, auch Chromsäure genannt, ist eine anorganische Verbindung mit der Formel CrO3. Es ist das Säureanhydrid der Chromsäure und wird manchmal unter demselben Namen vermarktet.
| IUPAC-Name | Chrom(VI)oxid |
| Molekularformel | CrO3 |
| CAS-Nummer | 1333-82-0 |
| Synonyme | Chromsäureanhydrid, Chromoxidanhydrid, Trioxochrom Chrom(VI)-oxid |
| InChI | InChI=1S/Cr.3O |
Eigenschaften von Chromtrioxid
Chromtrioxid-Formel
Die Formel für Chromsäureanhydrid lautet CrO3. Es besteht aus einem Chromatom, das an drei Sauerstoffatome gebunden ist.
Molmasse von Chromtrioxid
Die Molmasse von Chromsäureanhydrid wird durch Addition der Atommassen seiner Bestandteile Chrom (Cr) und Sauerstoff (O) berechnet. Die Molmasse beträgt ca. 99,994 g/mol.
Siedepunkt von Chromtrioxid
Chromsäureanhydrid hat keinen ausgeprägten Siedepunkt. Beim Erhitzen zerfällt es in Chromoxid und Sauerstoffgas, ohne eine flüssige Phase zu durchlaufen.
Schmelzpunkt von Chromtrioxid
Der Schmelzpunkt von Chromsäureanhydrid liegt bei etwa 196 °C. Bei dieser Temperatur geht es vom festen in den flüssigen Zustand über.
Dichte von Chromtrioxid g/ml
Die Dichte von Chromsäureanhydrid beträgt etwa 2,7 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar.
Molekulargewicht von Chromtrioxid
Das Molekulargewicht von Chromsäureanhydrid, auch Molmasse genannt, beträgt etwa 99,994 g/mol. Sie ist die Summe der Atommassen der Chrom- und Sauerstoffatome in der Verbindung.
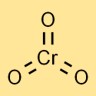
Struktur von Chromtrioxid
Chromsäureanhydrid hat eine Molekülstruktur, in der ein Chromatom zentral an drei Sauerstoffatome gebunden ist. Es nimmt eine tetraedrische Geometrie an, mit dem Chromatom in der Mitte und den Sauerstoffatomen an den Ecken.
Löslichkeit von Chromtrioxid
Chromsäureanhydrid ist in Wasser gut löslich. Es löst sich leicht auf und bildet eine Chromsäurelösung. Die Löslichkeit von Chromsäureanhydrid in Wasser ermöglicht den Einsatz in verschiedenen chemischen Prozessen und Anwendungen.
| Aussehen | Dunkelrote Kristalle |
| Spezifisches Gewicht | 2,7 g/ml |
| Farbe | Dunkelrot |
| Geruch | Geruchlos |
| Molmasse | 99,994 g/Mol |
| Dichte | 2,7 g/ml |
| Fusionspunkt | 196°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in verschiedenen Lösungsmitteln wie Ethanol, Ether usw. |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Säure (in Lösung) |
Sicherheit und Gefahren von Chromtrioxid
Chromsäureanhydrid birgt erhebliche Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es handelt sich um eine stark ätzende und oxidierende Substanz, die schwere Verätzungen der Haut, Augen und Atemwege verursachen kann. Das Einatmen oder Verschlucken von Chromsäureanhydrid kann zu Atembeschwerden, Magen-Darm-Problemen und sogar Organschäden führen.
Bei der Arbeit mit Chromsäureanhydrid sollte geeignete persönliche Schutzausrüstung (PSA) getragen werden, einschließlich Handschuhen, Schutzbrille und Atemschutzmaske. Es sollte an einem kühlen, trockenen Ort fern von unverträglichen Materialien und Zündquellen gelagert werden.
Die Entsorgung von Chromsäureanhydrid sollte gemäß den örtlichen Vorschriften erfolgen, da es als gefährlicher Abfall gilt. Es sollte nicht in die Umwelt gelangen.
| Gefahrensymbole | Ätzend, oxidierend |
| Sicherheitsbeschreibung | Kontakt mit Haut, Augen und Einatmen vermeiden. Verwenden Sie geeignete Schutzausrüstung. |
| UN-Identifikationsnummern | UN 1463 |
| HS-Code | 2819.90.90 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Chromtrioxid-Synthese
Es gibt verschiedene Methoden zur Synthese von Chromsäureanhydrid.
Eine gängige Methode ist die Reaktion zwischen Natriumdichromat und Schwefelsäure . In einer kontrollierten Umgebung mischt jemand Natriumdichromat (Na2Cr2O7) mit konzentrierter Schwefelsäure (H2SO4) . Bei der Reaktion entsteht eine dunkelrote Lösung aus Chromsäureanhydrid (CrO3) und Natriumsulfat (Na2SO4) als Nebenprodukt.
Eine weitere Methode ist die Oxidation von Chrom(III)-Verbindungen mit starken Oxidationsmitteln wie Wasserstoffperoxid (H2O2) oder Salpetersäure (HNO3) . Bei diesem Verfahren wird die Chrom(III)-Verbindung unter bestimmten Bedingungen mit dem Oxidationsmittel gemischt, um Chrom(III) in Chromsäureanhydrid umzuwandeln.
Stellen Sie Chromsäureanhydrid her, indem Sie metallisches Chrom oder Chrom(II)-Verbindungen mit starken Oxidationsmitteln wie Kaliumpermanganat (KMnO4) oder Kaliumdichromat (K2Cr2O7) reagieren lassen. Die Reaktion führt zur Bildung von Chromsäureanhydrid.
Es ist wichtig zu beachten, dass die Synthese von Chromsäureanhydrid mit entsprechenden Sicherheitsmaßnahmen und unter Einhaltung einschlägiger Vorschriften durchgeführt werden muss. Erfahrene Personen sollten den Syntheseprozess in gut ausgestatteten Labors durchführen, um ihre Sicherheit zu gewährleisten und die Auswirkungen auf die Umwelt zu minimieren.
Verwendung von Chromtrioxid
Chromsäureanhydrid findet als Oxidationsmittel in verschiedenen chemischen Prozessen Anwendung, darunter auch bei der Herstellung organischer Verbindungen.
- Hersteller stellen daraus Farbstoffe und Pigmente wie Chromgelb und Chromgrün her.
- In der Galvanikindustrie wird es verwendet, um Chrom auf Metalloberflächen abzuscheiden und so für Korrosionsbeständigkeit und ein attraktives Finish zu sorgen.
- Es wird zur Herstellung von Chromkatalysatoren für Polymerisationsreaktionen bei der Herstellung von Kunststoffen und synthetischen Materialien verwendet.
- Es spielt eine Rolle bei der Synthese von Arzneimitteln und organischen Zwischenprodukten.
- Bei Holzschutzbehandlungen wird es als Fungizid und Insektizid zum Schutz vor Fäulnis und Schädlingen eingesetzt.
- Labore verwenden es als Reagenz für verschiedene chemische Tests und Analysen.
- Seine Verwendung bei der Herstellung von Spezialgläsern und Keramik verbessert Farben und spezifische Eigenschaften.
- In der Gerberei wird es zur Behandlung von Leder eingesetzt und hilft dabei, Häute zu stabilisieren und zu färben.
- Es ist Bestandteil bei der Formulierung von Reinigungsmitteln und Oberflächenbehandlungen für Metalloberflächen.
Aufgrund seiner giftigen und ätzenden Natur ist es wichtig, mit Chromsäureanhydrid vorsichtig umzugehen. Die Einhaltung geeigneter Sicherheitsprotokolle gewährleistet den Schutz von Mensch und Umwelt bei der Verwendung und Entsorgung.
Fragen:
F: Was ist CrO3?
A: CrO3 ist Chromsäureanhydrid, eine Verbindung, die aus einem Chromatom besteht, das an drei Sauerstoffatome gebunden ist.
F: Ist CrO3 ein starkes Oxidationsmittel?
A: Ja, CrO3 ist ein starkes Oxidationsmittel, das häufig bei chemischen Reaktionen verwendet wird, um die Oxidation verschiedener Verbindungen zu erleichtern.
F: Was macht CrO3 mit Alkohol?
A: CrO3 kann Alkohole oxidieren und in die entsprechenden Carbonylverbindungen wie Aldehyde oder Ketone umwandeln.
F: Welches organische Produkt würden Sie durch die Reaktion von 1-Pentanol mit CrO3, H2O und H2SO4 erhalten?
A: Die Reaktion würde das organische Produkt 1-Pentanon ergeben, bei dem es sich um ein Keton handelt.
F: Welches Reagenz eignet sich am besten für die Durchführung der folgenden Transformation: PCC, HIO4, CrO3, NaOH?
A: Das beste Reagenz für diese Transformation wäre PCC (Pyridiniumchlorchromat).
F: Ist CrO3 amphoter?
A: Nein, CrO3 ist nicht amphoter. Es handelt sich um eine sehr saure Verbindung, die jedoch keine basischen Eigenschaften aufweisen kann.
F: Wie ermittelt man die Oxidationszahl von Cr in CrO3?
A: Die Oxidationszahl von Cr in CrO3 beträgt +6.
F: Wie heißt CrO3?
A: Der Name von CrO3 ist Chromsäureanhydrid.
F: Was macht CrO3 mit nichtanonischen Alkoholen?
A: CrO3 kann nicht-anonische Alkohole oxidieren und sie in die entsprechenden Carbonylverbindungen, wie z. B. nicht-anonische Ketone, umwandeln.
F: Welche Ladung hat das Übergangsmetallkation in CrO3?
A: Das Übergangsmetallkation in CrO3, also Chrom, hat eine Ladung von +6.
