Kaliumdichromat ist eine leuchtend orangefarbene chemische Verbindung, die in einer Vielzahl von Anwendungen eingesetzt wird. Es ist ein starkes Oxidationsmittel und kann bei Einnahme oder Einatmen giftig sein.
| IUPAC-Name | Kaliumdichromat |
| Molekularformel | K2Cr2O7 |
| CAS-Nummer | 7778-50-9 |
| Synonyme | Kaliumdichromat, Kaliumchromat (VI), Kalidichromat |
| InChI | InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;/h;;2*;7*1- |
Eigenschaften von Kaliumdichromat
Formel für Kaliumdichromat
Die Formel für Kaliumdichromat lautet K2Cr2O7. Es besteht aus zwei Kaliumatomen (K), zwei Chromatomen (Cr) und sieben Sauerstoffatomen (O). Jedes Kaliumatom hat eine Ladung von +1, während jedes Chromatom eine Ladung von +6 hat. Das Vorhandensein von zwei Chromatomen in der Formel weist auf die dimere Struktur der Verbindung hin.
Molmasse von Kaliumdichromat
Die Molmasse von Kaliumdichromat wird durch Addition der Atommassen seiner Bestandteile berechnet. Kalium hat eine Molmasse von 39,10 Gramm pro Mol (g/mol), Chrom hat eine Molmasse von 52,00 g/mol und Sauerstoff hat eine Molmasse von 16,00 g/mol. Die Molmasse von Kaliumdichromat beträgt somit 294,18 g/mol.
Siedepunkt von Kaliumdichromat
Kaliumdichromat hat keinen bestimmten Siedepunkt, da es sich zersetzt, bevor es den Siedepunkt erreicht. Beim Erhitzen zersetzt es sich jedoch thermisch und setzt giftige Dämpfe aus Chromoxid und Sauerstoff frei.
Kaliumdichromat Schmelzpunkt
Der Schmelzpunkt von Kaliumdichromat liegt bei etwa 398 Grad Celsius (°C) oder 748 Grad Fahrenheit (°F). Bei dieser Temperatur gehen die festen Kaliumdichromatkristalle in einen flüssigen Zustand über.
Dichte von Kaliumdichromat g/ml
Die Dichte von Kaliumdichromat beträgt etwa 2,68 Gramm pro Milliliter (g/ml). Dies weist darauf hin, dass ein bestimmtes Volumen Kaliumdichromat relativ schwerer ist als ein gleiches Volumen Wasser.
Molekulargewicht von Kaliumdichromat
Das Molekulargewicht von Kaliumdichromat entspricht seiner Molmasse, die 294,18 Gramm pro Mol (g/mol) beträgt. Es stellt die Gesamtmasse aller in einem Molekül der Verbindung vorhandenen Atome dar.
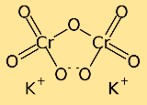
Struktur von Kaliumdichromat
Kaliumdichromat hat eine dimere Struktur, das heißt, es besteht aus zwei Chromatomen, die durch Sauerstoffatome miteinander verbunden sind. Kaliumatome sind auch an Sauerstoffatome gebunden, wodurch in der Verbindung ein komplexes Atomnetzwerk entsteht.
Löslichkeit von Kaliumdichromat
Kaliumdichromat ist in Wasser sehr gut löslich. Es löst sich leicht in Wasser und bildet eine orangefarbene Lösung. Die Löslichkeit von Kaliumdichromat steigt mit der Temperatur. Allerdings ist seine Löslichkeit in organischen Lösungsmitteln begrenzt.
| Aussehen | Leuchtend orangefarbene Kristalle |
| Spezifisches Gewicht | 2,68 g/ml |
| Farbe | Orange |
| Geruch | Geruchlos |
| Molmasse | 294,18 g/Mol |
| Dichte | 2,68 g/ml |
| Fusionspunkt | 398 °C (748 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, begrenzt in organischen Lösungsmitteln |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Sauer (ca. pH 4) |
Sicherheit und Gefahren von Kaliumdichromat
Kaliumdichromat birgt erhebliche Sicherheitsrisiken. Es ist hochgiftig, wenn es verschluckt, eingeatmet oder mit der Haut in Berührung kommt. Die Verbindung ist ein starkes Oxidationsmittel, das mit brennbaren Materialien heftig reagieren kann, wodurch die Brandgefahr steigt. Der Kontakt mit Kaliumdichromat kann zu schweren Hautreizungen, Verbrennungen und allergischen Reaktionen führen. Das Einatmen seiner Dämpfe oder Stäube kann Atemprobleme und Lungenschäden verursachen. Eine langfristige Exposition ist mit gesundheitsschädlichen Auswirkungen verbunden, einschließlich chromatinduziertem Lungenkrebs. Es ist wichtig, mit Kaliumdichromat mit äußerster Vorsicht umzugehen, geeignete Schutzausrüstung zu tragen und für ausreichende Belüftung zu sorgen, um Gesundheits- und Sicherheitsrisiken zu minimieren.
| Gefahrensymbole | Ätzend, Gesundheitsgefährdend, Akut giftig |
| Sicherheitsbeschreibung | – Sehr giftig – Ätzend – Verursacht Verätzungen |
| UN-Identifikationsnummern | UN 3086 (Klasse 6.1) |
| HS-Code | 2841.10.10 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Akute orale Toxizität: Sehr giftig<br>Chronische Toxizität: Karzinogenes Potenzial |
Hinweis: Bei den in der Tabelle verwendeten Gefahrensymbolen handelt es sich um allgemein anerkannte internationale Symbole. Für umfassende Informationen zur Handhabung und Lagerung von Kaliumdichromat ist es wichtig, die spezifischen Vorschriften und Sicherheitshinweise zu beachten.
Methoden zur Kaliumdichromat-Synthese
Es gibt verschiedene Methoden zur Synthese von Kaliumdichromat. Eine häufig verwendete Methode beinhaltet die Reaktion zwischen Kaliumchromat (K2CrO4) und Chromsäure (H2CrO4) . Die Reaktion findet in einer sauren Umgebung statt, meist mit Schwefelsäure (H2SO4) als Katalysator. Die Reaktion kann es auf den Punkt bringen.
2K2CrO4 + 2H2CrO4 + 2H2SO4 → K2Cr2O7 + Cr2(SO4)3 + 4H2O
Eine andere Methode beinhaltet die Oxidation von Kaliumchromat unter Verwendung eines starken Oxidationsmittels wie konzentrierter Schwefelsäure (H2SO4) und eines Reduktionsmittels wie Ethanol (C2H5OH). Die Reaktion kann es auf den Punkt bringen.
2K2CrO4 + H2SO4 + 3C2H5OH → K2Cr2O7 + Cr2(SO4)3 + 7H2O + 3CO2
Kaliumhydroxid (KOH) reagiert mit Chromtrioxid (CrO3) in einem wässrigen Medium unter Bildung von Kaliumdichromat. In einem wässrigen Medium findet die Reaktion statt. Die Reaktion kann es auf den Punkt bringen.
2KOH + CrO3 → K2Cr2O7 + H2O
Diese Synthesemethoden erfordern aufgrund der toxischen und ätzenden Natur der beteiligten Reagenzien entsprechende Sicherheitsvorkehrungen. Es ist wichtig, diese Reaktionen in einem gut belüfteten Bereich durchzuführen, Schutzausrüstung zu tragen und vorsichtig mit Chemikalien umzugehen. Darüber hinaus ist die Einhaltung ordnungsgemäßer Abfallentsorgungsprotokolle von entscheidender Bedeutung, um die Auswirkungen auf die Umwelt zu minimieren.
Verwendung von Kaliumdichromat
Aufgrund seiner einzigartigen Eigenschaften findet Kaliumdichromat in verschiedenen Bereichen Anwendung. Hier sind einige seiner häufigsten Verwendungszwecke:
- Oxidationsmittel: Bei chemischen Reaktionen wird häufig Kaliumdichromat als starkes Oxidationsmittel verwendet, um Alkohole zu Aldehyden oder Ketonen zu oxidieren.
- Laborreagenz: In der analytischen Chemie wird Kaliumdichromat als Reagenz für Tests und Experimente verwendet, einschließlich der Bestimmung organischer Verbindungen und der Durchführung von Redoxreaktionen.
- Gerbereiindustrie: Die Lederindustrie verwendet Kaliumdichromat als Gerbstoff, um Tierhäute zu behandeln und sie in langlebige Lederprodukte umzuwandeln.
- Fotografie: Bei der Schwarzweißfotografie wird Kaliumdichromat in Entwicklungslösungen eingearbeitet und zur Sensibilisierung von Emulsionen verwendet, um bestimmte fotografische Effekte zu erzielen.
- Holzschutz: Um Holz vor Fäulnis, Pilzen und Insektenbefall zu schützen, verwendet die Holzschutzindustrie Kaliumdichromat als hochgiftiges Holzschutzmittel.
- Pigmentherstellung: Kaliumdichromat spielt eine wichtige Rolle bei der Herstellung von Pigmenten wie Chromgelb und Chromorange, die in der Industrie in Farben, Tinten und Farbstoffen verwendet werden.
- Galvanisieren: Bei Galvanikverfahren wird Kaliumdichromat verwendet, um eine dekorative, korrosionsbeständige Beschichtung auf Metallen wie Zink, Aluminium und Messing bereitzustellen.
- Pyrotechnik: Kaliumdichromat spielt eine wesentliche Rolle in pyrotechnischen Mischungen und verleiht Feuerwerkskörpern und Fackeln leuchtend orange Farben.
- Textilindustrie: Beim Färben und Bedrucken von Textilien wird Kaliumdichromat verwendet, um die gewünschten Farben zu erzielen und die Farbechtheit zu verbessern.
- Kalibrierung von Laborglasgeräten: Für präzise Volumenmessungen werden Kaliumdichromatlösungen zur Kalibrierung von Laborglasgeräten verwendet.
Diese vielfältigen Anwendungen unterstreichen die Vielseitigkeit und Bedeutung von Kaliumdichromat in verschiedenen Branchen und wissenschaftlichen Bestrebungen.
Fragen:
F: Wie lautet die richtige Formel für Kaliumdichromat?
A: Die korrekte Formel für Kaliumdichromat ist K2Cr2O7.
F: Was ist Kaliumdichromat?
A: Kaliumdichromat ist eine leuchtend orangefarbene chemische Verbindung und wird häufig als Oxidationsmittel verwendet.
F: Ist Kaliumdichromat ionisch oder kovalent?
A: Kaliumdichromat ist eine ionische Verbindung.
F: Wie viel Wasser ist mindestens erforderlich, um 3 Mol Kaliumdichromat aufzulösen?
A: Die Mindestmenge an Wasser, die zum Auflösen von 3 Mol Kaliumdichromat erforderlich ist, beträgt etwa 564 Gramm.
F: Wie groß ist die Molmasse von Kaliumdichromat?
A: Die Molmasse von Kaliumdichromat beträgt 294,18 Gramm pro Mol (g/mol).
F: Sicherheitsdatenblatt für Kaliumdichromat?
A: Sicherheitsdatenblätter (MSDS) für Kaliumdichromat enthalten detaillierte Informationen zu dessen Gefahren, Handhabung, Lagerung und Erste-Hilfe-Maßnahmen. Bitte wenden Sie sich für das spezifische Sicherheitsdatenblatt an zuverlässige Quellen oder Hersteller.
F: Wie wird Kaliumdichromat aus Chromiterz hergestellt?
A: Kaliumdichromat kann aus Chromerz hergestellt werden, indem man es mit Kaliumhydroxid oder Kaliumcarbonat röstet und das Produkt dann isoliert.
F: Wie viele Gramm Kaliumdichromat wurden in den Messkolben gegeben?
A: Die genaue Grammzahl Kaliumdichromat, die in den Messkolben gegeben wird, hängt von der gewünschten Konzentration und dem gewünschten Volumen der Lösung ab.
F: Wie würden Sie bei Verwendung von angesäuertem Kaliumdichromat zwischen Propanal und Propanon unterscheiden?
A: Propanal würde durch angesäuertes Kaliumdichromat zu Propansäure oxidiert, während Propanon (Aceton) keine Reaktion zeigen würde.
F: Ist Kaliumdichromat ein Reduktionsmittel?
A: Nein, Kaliumdichromat ist ein Oxidationsmittel.
F: Wie schreibt man die Formel für Kaliumdichromat?
A: Die Formel für Kaliumdichromat lautet K2Cr2O7.
