2-Buten (CH3CHCHCH3) ist ein farbloses Gas, das bei der Herstellung verschiedener Chemikalien verwendet wird. Es ist brennbar und verströmt einen leichten Geruch. 2-Buten wird häufig bei der Herstellung von synthetischem Kautschuk und anderen Polymeren verwendet.
| Name der IUPAC | Mais-2-ène |
| Molekularformel | C4H8 oder CH3CHCHCH3 |
| CAS-Nummer | 624-64-6 |
| Synonyme | 2-Buten, Butylen, Ethylethylen, But-2-en, B-Buten, Buten-2 |
| InChI | InChI=1S/C4H8/c1-3-4-2/h3-4H,1-2H3 |
Eigenschaften von 2-Buten
Formel 2-Buten
Die chemische Formel für 2-Buten lautet C4H8. Das bedeutet, dass das Molekül vier Kohlenstoffatome und acht Wasserstoffatome enthält. Die Formel gibt Aufschluss über die Art und Anzahl der im Molekül vorhandenen Atome, nicht jedoch über dessen Struktur oder Eigenschaften.
Molmasse von 2-Buten
But-2-en hat eine Molmasse von 56,11 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz und wird durch Addition der Atommassen aller Atome im Molekül berechnet. Für But-2-en gibt es vier Kohlenstoffatome und acht Wasserstoffatome, was insgesamt 56,11 g/mol ergibt.
Siedepunkt von 2-Buten
Der Siedepunkt von But-2-en beträgt 0,88 °C. Der Siedepunkt ist die Temperatur, bei der eine Flüssigkeit gasförmig wird. Im Fall von But-2-en handelt es sich bei Raumtemperatur um ein farbloses Gas, das jedoch durch Absenken der Temperatur zu einer Flüssigkeit kondensiert werden kann. Bei 0,88 °C beginnt But-2-en zu sieden und wird gasförmig.
2-Buten-Schmelzpunkt
But-2-en hat keinen eindeutigen Schmelzpunkt, da es bei Raumtemperatur als Gas vorliegt. Wenn es jedoch auf eine ausreichend niedrige Temperatur abgekühlt wird, kann es zu einer Flüssigkeit kondensieren. Zu diesem Zeitpunkt hängt die Temperatur, bei der es erstarrt, von den Bedingungen des Experiments ab.
Dichte von 2-Buten g/ml
Die Dichte von But-2-en beträgt bei Raumtemperatur und -druck 0,614 g/ml. Die Dichte ist die Menge an Masse pro Volumeneinheit. Im Fall von But-2-en bedeutet dies, dass auf jeden Milliliter But-2-en 0,614 Gramm Masse kommen.
Molekulargewicht von 2-Buten
Das Molekulargewicht von But-2-en beträgt 56,11 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Im Fall von But-2-en gibt es vier Kohlenstoffatome und acht Wasserstoffatome, was insgesamt 56,11 g/mol ergibt.
2-Buten-Struktur
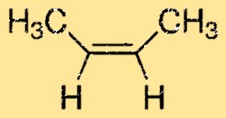
But-2-en hat eine lineare Struktur und gehört zur Gruppe der Alkene. Es verfügt über zwei Kohlenstoff-Kohlenstoff-Doppelbindungen, die ihm seine charakteristische Reaktivität verleihen. Das Molekül hat ein zentrales Kohlenstoffatom mit zwei daran gebundenen Methylgruppen und zwei Wasserstoffatomen, die an jedem der Kohlenstoffe an den Enden des Moleküls befestigt sind.
| Aussehen | Farbloses Gas |
| Spezifische Dichte | 0,614 bei 25°C |
| Farbe | Farblos |
| Geruch | Gutartig |
| Molmasse | 56,11 g/Mol |
| Dichte | 0,614 g/ml bei 25 °C |
| Fusionspunkt | -139,8°C |
| Siedepunkt | 0,88°C |
| Blitzpunkt | -19°C |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 276,8 kPa bei 25 °C |
| Wasserdampfdichte | 2,5 (Luft = 1) |
| pKa | 44 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von 2-Buten
But-2-en kann bei unsachgemäßer Handhabung mehrere Sicherheitsrisiken darstellen. Es ist leicht entflammbar und kann sich leicht entzünden, wenn es Hitze, Flammen oder Funken ausgesetzt wird. Es reizt außerdem die Atemwege und die Augen und kann beim Einatmen Schwindel, Kopfschmerzen und Übelkeit verursachen. Darüber hinaus ist es beim Verschlucken gesundheitsschädlich und kann innere Organe schädigen. Beim Umgang mit But-2-en sollten geeignete Sicherheitsmaßnahmen wie die Verwendung von Schutzausrüstung und gute Belüftung befolgt werden. Es ist wichtig, vor dem Umgang mit der Chemikalie eine entsprechende Schulung zu absolvieren und über die potenziellen Gefahren Bescheid zu wissen.
| Gefahrensymbole | Brennbar |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Explosionsgeschützte Elektro-/Lüftungs-/Beleuchtungsgeräte verwenden. Verwenden Sie nur funkenfreie Werkzeuge. Treffen Sie Vorsichtsmaßnahmen gegen statische Entladung. Halten Sie den Behälter fest verschlossen. An einem gut belüfteten Ort aufbewahren. |
| UN-Identifikationsnummern | UN1012 |
| HS-Code | 290110 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | Gesundheitsschädlich beim Verschlucken, Reizung der Atemwege und Augen. |
Methoden zur Synthese von 2-Buten
Zur Synthese von But-2-en gibt es verschiedene Methoden, darunter Kohlenwasserstoffcracken, 2-Butanol-Dehydratisierung und katalytische Dehydrierung von Butanen.
Beim Crackverfahren werden Kohlenwasserstoffe wie Naphtha, Diesel oder Kerosin auf hohe Temperaturen erhitzt, wodurch sie in kleinere Moleküle, darunter auch But-2-en, zerfallen. Der Prozess kann durch thermisches oder katalytisches Cracken durchgeführt werden.
Um But-2-en herzustellen, nutzen Menschen als weitere Methode die Dehydratisierung von 2-Butanol. Bei dieser Methode erhitzen sie 2-Butanol mit einem wasserentziehenden Mittel wie Schwefelsäure oder Phosphorsäure , um But-2-en und Wasser zu erzeugen. Die Reaktion ist reversibel und sie können Wasser aus der Reaktionsmischung entfernen, um die Reaktion in Richtung der Bildung von But-2-en voranzutreiben.
Eine weitere Methode zur Synthese von But-2-en ist die katalytische Dehydrierung von Butanen. Bei diesem Verfahren wird Butan über einem Katalysator wie Chrom-Aluminiumoxid oder Platin erhitzt, um But-2-en und Wasserstoff zu erzeugen. Die Reaktion ist stark exotherm und kann von Chemikern in einem Festbett- oder Wirbelschichtreaktor durchgeführt werden.
Verwendung von 2-Buten
But-2-en hat aufgrund seiner einzigartigen chemischen Eigenschaften ein breites Spektrum an industriellen und kommerziellen Anwendungen. Hier sind einige häufige Verwendungen von But-2-en:
- Butadienproduktion: Es ist eine Vorstufe von Butadien, einer Chemikalie, die bei der Herstellung von synthetischem Kautschuk und anderen Elastomeren verwendet wird.
- Kunststoffherstellung: Wird bei der Herstellung von Kunststoffen aus Polyethylen hoher Dichte (HDPE) und linearem Polyethylen niedriger Dichte (LLDPE) verwendet.
- Kraftstoffzusatz: Wird als Kraftstoffzusatz zur Erhöhung der Oktanzahl von Benzin verwendet.
- Lösungsmittel: Wird als Lösungsmittel in verschiedenen Branchen wie Farben, Beschichtungen und Klebstoffen verwendet.
- Chemisches Zwischenprodukt: Wird als Zwischenprodukt bei der Herstellung verschiedener Chemikalien wie Butanol, Butyraldehyd und Buttersäure verwendet.
- Kältemittel: Wird aufgrund seines niedrigen Siedepunkts und seiner guten Wärmeübertragungseigenschaften in einigen Anwendungen als Kältemittel verwendet.
- Forschung und Entwicklung: Wird auch in der Forschung und Entwicklung zur Untersuchung der Reaktionskinetik und Thermodynamik verschiedener chemischer Reaktionen verwendet.
Fragen:
F: Was beschreibt die Struktur von 2-Buten am besten?
A: But-2-en ist ein ungesättigter Kohlenwasserstoff mit einer Kette aus vier Kohlenstoffatomen und einer Doppelbindung zwischen dem zweiten und dritten Kohlenstoffatom.
F: Was ist die Hybridisierung an den beiden zentralen Kohlenstoffatomen von 2-Buten?
A: Die beiden zentralen Kohlenstoffatome von But-2-en sind sp²-hybridisiert, was bedeutet, dass sie jeweils drei hybridisierte Orbitale und ein nichthybridisiertes p-Orbital haben.
F: Welche Reagenzien können verwendet werden, um cis-2-Buten in trans-2-Buten umzuwandeln?
A: Reagenzien wie Brom oder Wasserstoffgas können verwendet werden, um cis-But-2-en durch einen als cis-trans-Isomerisierung bezeichneten Prozess in trans-But-2-en umzuwandeln.
F: Warum könnte es schwierig sein, die Trennung von cis- und trans-2-Buten durch TLC darzustellen?
A: Es kann schwierig sein, die Trennung von cis- und trans-But-2-en durch Dünnschichtchromatographie (TLC) sichtbar zu machen, da die beiden Isomere sehr ähnliche physikalische Eigenschaften wie Polarität und Herkunftsort haben. Sieden, was es schwierig macht, sie mittels DC zu unterscheiden.
F: Wie viele einzigartige Stereoisomere ergeben sich aus der Reaktion mit trans-But-2-en?
A: Die Reaktion mit trans-But-2-en führt zu zwei einzigartigen Stereoisomeren, da es nur zwei mögliche Konfigurationen von Substituenten um die Doppelbindung gibt: trans und cis.
