Le cyclopentadiène (C5H6) est un composé cyclique comportant cinq atomes de carbone et une double liaison. Il est couramment utilisé en synthèse organique et comme élément constitutif de diverses réactions chimiques.
| Nom UICPA | Cyclopentadiène |
| Formule moléculaire | C₅H₆ |
| Numero CAS | 542-92-7 |
| Synonymes | Cyclopenta-1,3-diène ; 1,3-cyclopentadiène ; dimère de 1,3-cyclopentadiène ; Dicyclopentadiène; DPC |
| InChI | InChI=1S/C5H6/c1-2-4-5-3-1/h1-4H,5H2 |
Propriétés du cyclopentadiène
Formule Cyclopentadiène
La formule chimique du cyclopentadiène est C₅H₆. Il est constitué de cinq atomes de carbone et de six atomes d’hydrogène. Cette formule représente la composition élémentaire du composé, donnant un aperçu de sa structure moléculaire et de ses propriétés.
Cyclopentadiène Masse molaire
La masse molaire du cyclopenta-1,3-diène est d’environ 66,10 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes de la formule. Dans le cas du cyclopenta-1,3-diène, la masse molaire dérive des masses atomiques du carbone et de l’hydrogène.
Point d’ébullition du cyclopentadiène
Le cyclopenta-1,3-diène a un point d’ébullition d’environ 41,5 °C. Le point d’ébullition est la température à laquelle une substance passe de sa phase liquide à sa phase gazeuse sous pression atmosphérique standard. Le point d’ébullition relativement bas du cyclopenta-1,3-diène le rend volatil et facilement vaporisable.
Cyclopentadiène Point de fusion
Le cyclopenta-1,3-diène n’a pas de point de fusion bien défini en raison de sa tendance à polymériser à des températures plus basses. Cependant, il peut exister à l’état congelé ou solide à des températures très basses. La présence d’impuretés ou de dimérisation peut affecter le comportement de fusion observé.
Densité du cyclopentadiène g/mL
La densité du cyclopenta-1,3-diène est d’environ 0,77 g/mL. La densité est une mesure de masse par unité de volume et indique à quel point les molécules sont serrées dans une substance. La densité relativement faible du cyclopenta-1,3-diène suggère qu’il est moins dense que l’eau et peut flotter à sa surface.
Cyclopentadiène Poids moléculaire
Le poids moléculaire du cyclopenta-1,3-diène est d’environ 66,10 g/mol. Il est calculé en additionnant les poids atomiques de tous les atomes de la molécule. Le poids moléculaire fournit des informations importantes sur la masse du composé et est utilisé dans divers calculs et conversions en chimie.
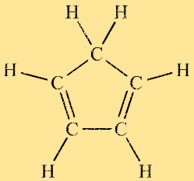
Structure du cyclopentadiène
Le cyclopenta-1,3-diène a une structure cyclique constituée d’un cycle carboné à cinq chaînons avec une alternance de liaisons simples et doubles. La molécule adopte une conformation planaire en raison de son caractère aromatique et présente une délocalisation électronique dans le système cyclique. Cette structure unique contribue à la réactivité et aux propriétés du cyclopenta-1,3-diène.
Solubilité du cyclopentadiène
Le cyclopenta-1,3-diène est peu soluble dans l’eau, mais il se dissout facilement dans de nombreux solvants organiques, tels que le benzène et l’éther. Ses caractéristiques de solubilité sont influencées par la polarité du solvant et la capacité des molécules de soluté à interagir avec les molécules de solvant. Le comportement de solubilité du cyclopenta-1,3-diène est important dans diverses applications impliquant la synthèse organique et les réactions chimiques.
| Apparence | Incolore |
| Gravité spécifique | 0,77 |
| Couleur | N / A |
| Odeur | Âcre |
| Masse molaire | 66,10 g/mole |
| Densité | 0,77 g/ml |
| Point de fusion | N / A |
| Point d’ébullition | 41,5 °C |
| Point d’éclair | -12 °C |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants organiques (benzène, éther) |
| Pression de vapeur | 110 mmHg à 25 °C |
| Densité de vapeur | 2,3 (air = 1) |
| pKa | N / A |
| pH | Neutre |
Sécurité et dangers du cyclopentadiène
Le cyclopenta-1,3-diène présente plusieurs risques pour la sécurité qui doivent être pris en compte. Il est hautement inflammable et peut former des mélanges explosifs avec l’air. Le composé a un faible point d’éclair de -12 °C, ce qui augmente le risque d’incendie. Il est également nocif s’il est avalé, inhalé ou absorbé par la peau et peut provoquer une irritation des yeux, de la peau et du système respiratoire. Le cyclopentadiène peut subir une polymérisation, entraînant un dégagement de chaleur et de pression. Il est important de manipuler ce produit chimique avec prudence, en utilisant des mesures de protection appropriées, comme le port de gants, de lunettes et d’une protection respiratoire. Des procédures appropriées de stockage, de manipulation et d’élimination doivent être suivies pour minimiser les risques.
| Symboles de danger | Inflammable |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes nues. Utiliser dans un endroit bien ventilé. Portez des gants et des lunettes de protection. Évitez l’inhalation ou le contact avec la peau. |
| Numéros d’identification de l’ONU | ONU 2044 |
| Code SH | 29021900 |
| Classe de danger | 3 (Liquide inflammable) |
| Groupe d’emballage | II |
| Toxicité | Nocif en cas d’ingestion, inhalation ou absorption par la peau. Peut provoquer des irritations. Des précautions appropriées doivent être prises lors de la manipulation. |
Méthodes de synthèse du cyclopentadiène
Diverses méthodes permettent la synthèse du cyclopenta-1,3-diène.
Une approche courante pour synthétiser le cyclopenta-1,3-diène implique la dimérisation du butadiène . Dans cette méthode, des complexes de métaux de transition tels que le nickel ou le cobalt catalysent une réaction de cycloaddition [4+2] entre deux molécules de butadiène , entraînant la formation de cyclopenta-1,3-diène.
Soumettre la cyclopentanone , une cétone cyclique, à des températures élevées en présence d’un catalyseur acide permet sa réaction de décomposition thermique, entraînant la formation de cyclopenta-1,3-diène. Cette réaction donne du cyclopenta-1,3-diène comme l’un des produits.
La déshydrogénation du cyclopentène, un hydrocarbure insaturé, constitue une autre méthode de synthèse du cyclopenta-1,3-diène. Ce procédé implique l’utilisation de catalyseurs tels que le platine ou le palladium pour faciliter l’élimination de deux atomes d’hydrogène du cyclopentène, entraînant la formation de cyclopenta-1,3-diène.
En exposant le dicyclopentdiène, un composé dimère, à des températures élevées, la réaction rétro-Diels-Alder se produit, conduisant à la synthèse du cyclopenta-1,3-diène. Ce processus thermique induit une réaction de cycloaddition [4+2] inverse, conduisant à la production de cyclopenta-1,3-diène.
Ces méthodes de synthèse proposent différentes voies d’obtention du cyclopenta-1,3-diène, permettant aux chercheurs et aux chimistes de choisir l’approche la plus adaptée en fonction de leurs besoins spécifiques et des ressources disponibles.
Utilisations du cyclopentadiène
Le cyclopenta-1,3-diène trouve une application dans divers domaines en raison de ses propriétés polyvalentes. Voici quelques utilisations courantes du cyclopenta-1,3-diène :
- Le cyclopenta-1,3-diène joue un rôle crucial dans divers domaines car il possède des propriétés polyvalentes. Il constitue un élément de base précieux dans la synthèse organique, permettant la production de nombreux composés, notamment des produits pharmaceutiques, des polymères et des produits chimiques spécialisés.
- La réaction Diels-Alder utilise largement le cyclopenta-1,3-diène, car il agit comme un composant diène et facilite la construction de structures cycliques complexes en chimie organique. Cette réaction permet la formation de systèmes cycliques fusionnés.
- Dans la production de polymères, le cyclopenta-1,3-diène agit comme monomère et contribue à la fabrication de caoutchoucs et d’élastomères synthétiques. Il joue un rôle essentiel dans le développement de matériaux dotés de propriétés mécaniques souhaitables.
- Le cyclopenta-1,3-diène trouve une application dans la formulation d’adhésifs et de revêtements en raison de sa réactivité et de sa capacité à subir des réactions de réticulation. Il améliore l’adhérence et la durabilité de ces produits, les rendant ainsi adaptés à diverses applications.
- Les additifs pour carburant, tels que le méthylcyclopentadiényl manganèse tricarbonyle (MMT), utilisent des dérivés du cyclopenta-1,3-diène pour améliorer l’efficacité de la combustion et réduire le cliquetis du moteur dans l’essence.
- Le cyclopenta-1,3-diène joue un rôle important dans les études d’aromaticité car il présente des caractéristiques aromatiques grâce à sa structure cyclique. Les chercheurs l’utilisent comme composé modèle pour comprendre et étudier les systèmes aromatiques.
Des questions:
Q : Qu’est-ce que le cyclopentadiène dimérise ?
R : Le cyclopenta-1,3-diène peut subir une dimérisation, où deux molécules de cyclopentadiène se combinent pour former un dimère appelé dicyclopentadiène.
Q : Le cyclopentadiène est-il aromatique ?
R : Oui, le cyclopenta-1,3-diène est considéré comme aromatique en raison de sa structure planaire et de la présence d’un système conjugué de liaisons simples et doubles alternées.
Q : Pourquoi le 1,3-cyclopentadiène (pKa = 16) est-il un acide beaucoup plus fort que le cyclopentane (pKa = 44) ?
R : Le 1,3-cyclopentadiène est plus acide que le cyclopentane car il possède un système conjugué d’électrons pi, qui stabilise la charge négative résultante lors de la déprotonation, facilitant ainsi la perte d’un ion hydrogène.
Q : Lequel des éléments suivants réagirait le plus rapidement avec le 1,3-cyclopentadiène ?
R : Les composés comportant des doubles liaisons électrophiles, tels que l’anhydride maléique ou les aldéhydes, réagiraient plus rapidement avec le 1,3-cyclopentadiène en raison de la nature nucléophile du cyclopentadiène.
Q : Pourquoi le cyclopentadiène se fissure-t-il ?
R : Le cyclopentadiène peut subir un craquage, un processus au cours duquel il subit une décomposition thermique, entraînant souvent la formation de fragments plus petits ou une polymérisation, en raison de sa réactivité inhérente et de sa tendance à subir des réarrangements.
Q : pKa du cyclopentadiène ?
R : Le pKa du cyclopenta-1,3-diène est d’environ 16.
Q : Monomère de cyclopentadiène ?
R : Le cyclopenta-1,3-diène existe principalement sous forme de monomère, mais il peut se dimériser dans certaines conditions pour former du dicyclopentadiène.
Q : Réaction du cyclopentadiène avec l’anhydride maléique ?
R : Le cyclopenta-1,3-diène subit une réaction de Diels-Alder avec l’anhydride maléique pour former l’adduit cyclopentadiène-anhydride maléique, une voie de synthèse courante pour la production de divers composés.
