Le cyclohexène (C6H10) est un hydrocarbure cyclique à double liaison, couramment utilisé comme solvant et intermédiaire dans les réactions chimiques en raison de sa réactivité et de sa polyvalence.
| Nom UICPA | Cyclohexène |
| Formule moléculaire | C₆H₁₀ |
| Numero CAS | 110-83-8 |
| Synonymes | Monocyclohexène, Hexanaphtène, 1,2-dihydrobenzène |
| InChI | InChI=1S/C6H10/c1-2-4-6-5-3-1/h1-2H,3-6H2 |
Propriétés du cyclohexène
Formule Cyclohexène
La formule du cyclohexène est C₆H₁₀, représentant sa composition moléculaire. Il se compose de six atomes de carbone disposés en anneau, chaque atome de carbone étant lié à deux atomes d’hydrogène. Cette structure cyclique confère au cyclohexène ses propriétés et sa réactivité uniques.
Cyclohexène Masse molaire
La masse molaire du monocyclohexène peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Elle est déterminée en additionnant les masses atomiques de six atomes de carbone (12,01 g/mol chacun) et de dix atomes d’hydrogène (1,008 g/mol chacun). Ainsi, la masse molaire du monocyclohexène est d’environ 82,14 g/mol.
Point d’ébullition du cyclohexène
Le monocyclohexène présente un point d’ébullition relativement bas d’environ 83-85°C (181-185°F). Ce faible point d’ébullition le rend adapté à diverses applications en tant que solvant ou intermédiaire réactionnel. Le point d’ébullition relativement bas permet une séparation et une récupération faciles du monocyclohexène au cours de divers processus industriels.
Cyclohexène Point de fusion
Le point de fusion du monocyclohexène est d’environ -104 à -103°C (-155 à -153°F). Ce faible point de fusion permet au monocyclohexène d’exister à l’état liquide à température ambiante et facilite son utilisation comme réactif ou solvant dans une large gamme de réactions et de processus chimiques.
Densité du cyclohexène g/mL
Le monocyclohexène a une densité d’environ 0,81 à 0,83 g/mL à température ambiante. Cette valeur de densité indique que le monocyclohexène est moins dense que l’eau, ce qui lui permet de flotter à la surface de l’eau. La densité du monocyclohexène joue un rôle crucial dans la détermination de son comportement dans diverses applications industrielles et de laboratoire.
Cyclohexène Poids moléculaire
Le poids moléculaire du monocyclohexène, qui est la somme des poids atomiques de tous les atomes d’une molécule, est d’environ 82,14 g/mol. Cette valeur de poids moléculaire est essentielle pour calculer la stœchiométrie, déterminer les quantités de réactifs et comprendre les propriétés physiques et chimiques du monocyclohexène.
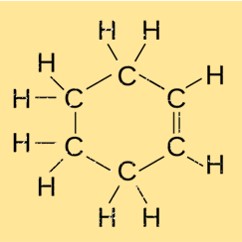
Structure du cyclohexène
Le monocyclohexène possède une structure moléculaire unique caractérisée par un cycle carboné à six chaînons avec une double liaison entre deux atomes de carbone adjacents. Cette structure confère à la fois stabilité et réactivité au monocyclohexène, ce qui en fait un composé polyvalent dans diverses réactions chimiques et synthèse organique.
Solubilité du cyclohexène
Le monocyclohexène présente une solubilité limitée dans l’eau en raison de sa nature non polaire. Cependant, il est très soluble dans les solvants organiques comme l’éthanol, l’acétone et l’éther. Ce comportement de solubilité permet au monocyclohexène d’être facilement mélangé et dissous dans des solvants organiques, améliorant ainsi son application en tant que réactif ou solvant dans divers processus.
| Apparence | Incolore |
| Gravité spécifique | 0,81-0,83 |
| Couleur | Incolore |
| Odeur | Doux, semblable à l’éther |
| Masse molaire | 82,14 g/mole |
| Densité | 0,81-0,83 g/mL |
| Point de fusion | -104 à -103°C |
| Point d’ébullition | 83-85°C |
| Point d’éclair | -7°C |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 184 mmHg |
| Densité de vapeur | 2,9 (air = 1) |
| pKa | ~15,5 |
| pH | N’est pas applicable |
Sécurité et dangers du cyclohexène
Le monocyclohexène présente certains risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Il est inflammable et peut s’enflammer à basse température. Lorsque vous travaillez avec du monocyclohexène, il est important d’assurer une ventilation adéquate pour éviter l’accumulation de vapeurs. Le contact direct avec le liquide ou la vapeur doit être évité car cela pourrait provoquer une irritation de la peau, des yeux et du système respiratoire. Une exposition prolongée ou répétée peut entraîner des effets néfastes sur la santé. En cas d’ingestion ou d’inhalation, des soins médicaux immédiats sont nécessaires. Il est essentiel de suivre des procédures appropriées de stockage et de manipulation, y compris l’utilisation d’un équipement de protection individuelle approprié, afin de minimiser les risques potentiels associés au monocyclohexène.
| Symboles de danger | XI |
| Description de la sécurité | Peut provoquer une irritation de la peau et des yeux. Liquide et vapeur inflammables. |
| Numéros d’identification de l’ONU | ONU 2256, ONU 2257 |
| Code SH | 2902.19.0000 |
| Classe de danger | 3 (Liquide inflammable) |
| Groupe d’emballage | III (Faible danger) |
| Toxicité | Peut entraîner des effets néfastes sur la santé en cas d’exposition prolongée ou répétée. |
Méthodes de synthèse du cyclohexène
Diverses méthodes peuvent synthétiser le monocyclohexène.
Une méthode courante est la déshydrogénation catalytique du cyclohexanol , qui implique l’utilisation d’un catalyseur tel que le cuivre ou le platine. Le catalyseur facilite l’élimination des atomes d’hydrogène lors du chauffage du cyclohexanol à des températures élevées, entraînant la formation de monocyclohexène.
Une autre méthode est la réaction d’élimination du cyclohexanol avec un acide fort, tel que l’acide sulfurique ou l’acide phosphorique. Le catalyseur acide favorise l’élimination d’une molécule d’eau du cyclohexanol, conduisant à la formation de monocyclohexène.
De plus, la pyrolyse du cyclohexanol ou de la cyclohexylamine donne du monocyclohexène. La pyrolyse consiste à soumettre le matériau de départ à des températures élevées en l’absence d’oxygène, provoquant la rupture des liaisons moléculaires et la formation de monocyclohexène.
Des agents oxydants tels que le trioxyde de chrome ou le permanganate de potassium oxydent le cyclohexane pour synthétiser le monocyclohexène. Cette réaction d’oxydation convertit le cyclohexane en monocyclohexène en introduisant une double liaison dans le cycle carboné.
Chacune de ces méthodes offre des avantages distincts en fonction des exigences spécifiques de la synthèse. Pour obtenir des rendements élevés et la pureté souhaitée du produit dans la synthèse du monocyclohexène, il faut soigneusement considérer les conditions de réaction, les catalyseurs et les techniques de purification.
Utilisations du cyclohexène
Le monocyclohexène trouve diverses applications en raison de ses propriétés uniques et de sa réactivité. Voici quelques utilisations clés du monocyclohexène :
- Solvant : Le monocyclohexène sert de solvant polyvalent dans de nombreuses réactions chimiques, en particulier celles impliquant des composés non polaires ou légèrement polaires. Il dissout généralement les huiles, les résines, les cires et autres substances organiques.
- Intermédiaire dans la synthèse chimique : Le monocyclohexène joue un rôle crucial en tant qu’intermédiaire dans la synthèse de divers produits chimiques, dont l’acide adipique, un composant clé utilisé dans la production de nylon. Il sert également de précurseur pour la synthèse du cyclohexanol et de la cyclohexanone.
- Polymérisation : Le poly(monocyclohexène), un polymère utilisé dans les revêtements, les adhésifs et les élastomères, utilise le monocyclohexène comme monomère dans sa production.
- Réactions organiques : Le monocyclohexène participe à un large éventail de réactions organiques, telles que les réactions de cycloadditions, d’oxydation et de réduction. Il est particulièrement utile dans la formation de composés cycliques et comme réactif dans la synthèse de produits pharmaceutiques, de parfums et d’arômes.
- Extraction et purification : Lors de la purification de produits naturels, notamment des extraits de plantes, des huiles essentielles et des arômes, les chercheurs utilisent le monocyclohexène comme solvant d’extraction. Son faible point d’ébullition permet une séparation facile des composés extraits.
- Applications de recherche et de laboratoire : Le monocyclohexène sert de réactif précieux en laboratoire pour diverses expériences et réactions en raison de ses propriétés de stabilité, de réactivité et de solvabilité.
La diversité des applications du monocyclohexène met en évidence son importance dans l’industrie chimique, les laboratoires de recherche et divers processus de fabrication.
Des questions:
Q : Quel composé est produit lorsque le cyclohexène est traité avec du KMnO4 concentré ?
R : Lorsque le monocyclohexène est traité avec du KMnO4 concentré, le composé cyclohexanone est produit.
Q : Comment pouvez-vous faire la distinction entre le cyclohexane et le cyclohexène en utilisant l’IR ?
R : Le cyclohexane et le monocyclohexène peuvent être distingués par spectroscopie IR en examinant la présence ou l’absence d’un pic d’étirement caractéristique C=C autour de 1 630-1 670 cm^-1 dans le spectre du monocyclohexène.
Q : Le cyclohexène est-il aromatique ?
R : Non, le monocyclohexène n’est pas aromatique. C’est un composé cyclique avec une double liaison, mais il ne possède pas les critères nécessaires pour être considéré comme aromatique.
Q : Combien de stéréoisomères possibles existent pour la bromation du cyclohexène ?
R : Il existe deux stéréoisomères possibles (cis et trans) pour la bromation du monocyclohexène, résultant de l’ajout de brome à la double liaison.
Q : Un produit insaturé résulte de la réaction du cyclohexène avec lequel de ceux-ci ?
R : Un produit insaturé résulte de la réaction du monocyclohexène avec un diénophile dans une réaction de Diels-Alder.
Q : Comment trouver le pourcentage de rendement du cyclohexène ?
R : Le pourcentage de rendement en monocyclohexène peut être calculé en divisant le rendement réel en monocyclohexène par le rendement théorique, puis en multipliant par 100 %.
Q : Comment convertir le cyclopentyl méthan-1-ol en cyclohexène ?
R : Le cyclopentyl méthan-1-ol peut être converti en monocyclohexène en le soumettant à une déshydratation, généralement à l’aide d’un catalyseur acide tel que l’acide sulfurique concentré ou l’acide phosphorique.
