Le cyclohexanol ou C6H11OH est un liquide huileux incolore avec une légère odeur. Il est couramment utilisé comme solvant et dans la production de nylon et d’autres produits chimiques.
| Nom UICPA | Cyclohexanol |
| Formule moléculaire | C6H12O ou C6H11OH |
| Numero CAS | 108-93-0 |
| Synonymes | Hexahydrophénol ; Hydrophénol ; Alcool cyclohexylique ; Hexaline ; Cyclohexanolol |
| Structure chimique | InChI=1S/C6H12O/c7-6-4-2-1-3-5-6/h6-7H,1-5H2 |
Structure du cyclohexanol
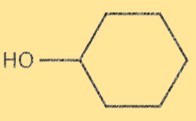
Le cyclohexanol possède un cycle carboné à six chaînons avec un groupe hydroxyle (-OH) attaché à l’un des atomes de carbone. La formule moléculaire du cyclohexanol est C6H12O. Le cycle cyclohexane a une conformation chaise avec le groupe hydroxyle situé en position axiale. La structure du cyclohexanol est importante car elle détermine ses propriétés physiques et chimiques.
Formule Cyclohexanol
La formule chimique du cyclohexanol est C6H12O. Cela représente le nombre et les types d’atomes dans une molécule de cyclohexanol. La formule est importante car elle est utilisée pour calculer la quantité de cyclohexanol nécessaire dans une réaction. De plus, il est utilisé pour déterminer la stœchiométrie d’une réaction.
Spectre IR du cyclohexanol
Le spectre IR du cyclohexanol présente un pic large et fort à environ 3 400 cm-1 en raison de la présence du groupe hydroxyle (-OH). Ce pic est révélateur de la présence d’un alcool. De plus, le spectre montre plusieurs pics dans la plage 1 000-1 300 cm-1 en raison de la présence du cycle cyclohexane. Le spectre IR du cyclohexanol est important car il peut être utilisé pour identifier et caractériser la substance.
Cyclohexanol Masse molaire
La somme des masses atomiques de tous les atomes d’une molécule de cyclohexanol permet de calculer sa masse molaire, qui est de 100,16 g/mol. La masse molaire joue un rôle crucial dans la détermination de la quantité de cyclohexanol requise dans une réaction et dans la conversion entre grammes et moles dans les calculs stœchiométriques.
Cyclohexanol Point d’ébullition
Le point d’ébullition du cyclohexanol est de 161,5°C (322,7°F). C’est la température à laquelle la phase liquide du cyclohexanol se transforme en phase gazeuse. Le point d’ébullition est une propriété physique importante car il est utilisé pour purifier et séparer le cyclohexanol des autres substances d’un mélange. Le point d’ébullition relativement élevé du cyclohexanol le rend utile comme solvant dans les réactions nécessitant des températures élevées.
C6H11OH Point de fusion
C6H11OH a un point de fusion de 25,93°C (78,67°F). C’est la température à laquelle la phase solide de C6H11OH se transforme en phase liquide. Le point de fusion est une propriété physique importante car il est utilisé pour identifier et caractériser C6H11OH. Il est également utilisé pour déterminer la pureté du C6H11OH.
C6H11OH Densité g/mL
C6H11OH a une densité de 0,962 g/mL à 25°C (77°F). Il s’agit de la masse de C6H11OH par unité de volume de la substance. La densité est une propriété physique importante car elle est utilisée pour déterminer la masse de C6H11OH nécessaire à une réaction. De plus, il est utilisé pour calculer la concentration de C6H11OH dans une solution.
C6H11OH Poids moléculaire
C6H11OH a un poids moléculaire de 100,16 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule de C6H11OH. Le poids moléculaire est une propriété importante car il est utilisé pour calculer la quantité de C6H11OH nécessaire dans une réaction. De plus, il est utilisé pour convertir entre grammes et moles dans les calculs stœchiométriques.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,962 g/ml |
| Couleur | Incolore |
| Odeur | Légère odeur |
| Masse molaire | 100,16 g/mole |
| Densité | 0,962 g/ml |
| Point de fusion | 25,93°C (78,67°F) |
| Point d’ébullition | 161,5°C (322,7°F) |
| Point d’éclair | 70°C (158°F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans de nombreux solvants organiques |
| La pression de vapeur | 0,14 kPa (à 25°C) |
| Densité de vapeur | 3,5 (air = 1) |
| pKa | 16.1 |
| pH | 6 à 8 |
Remarque : Les valeurs présentées dans ce tableau sont approximatives et peuvent varier selon la source d’information.
Sécurité et dangers du cyclohexanol
Le C6H11OH doit être manipulé avec prudence car il présente certains risques et dangers pour la sécurité. L’exposition à ce produit chimique peut provoquer une irritation de la peau, des yeux et du système respiratoire. Il peut également provoquer des maux de tête, des étourdissements et des nausées en cas d’inhalation. L’ingestion de C6H11OH peut entraîner des douleurs abdominales, des vomissements et de la diarrhée. Ce produit chimique est inflammable et peut s’enflammer lorsqu’il est exposé à la chaleur ou aux flammes. Il est important de le stocker et de le manipuler dans un endroit frais et sec, à l’écart de la chaleur et des sources d’ignition. Des équipements de protection tels que des gants, des lunettes et des masques respiratoires doivent être utilisés lors de la manipulation du C6H11OH. En cas d’exposition, consulter immédiatement un médecin.
| Symboles de danger | XI |
| Description de la sécurité | S26 – En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin.<br> S36/37/39 – Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage.<br>S45 – En cas d’accident ou en cas de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette). |
| Identifiants ONU | ONU1986 |
| Code SH | 2907.13.00 |
| Classe de danger | 3 |
| Groupe d’emballage | III |
| Toxicité | Toxicité faible à modérée |
Méthodes de synthèse du cyclohexanol
Le C6H11OH peut être synthétisé par plusieurs méthodes.
- Une méthode courante pour produire du C6H11OH consiste à hydrogéner catalytiquement du phénol en présence d’un catalyseur métallique tel que le nickel ou le platine. Cette méthode consiste à réduire le cycle aromatique du phénol pour former C6H11OH.
- Une autre méthode implique l’oxydation du cyclohexane à l’aide d’air ou d’oxygène en présence d’un catalyseur tel que le cuivre ou le cobalt. Ce processus produit du C6H11OH comme produit intermédiaire qui peut être davantage oxydé pour former de la cyclohexanone.
- C6H11OH peut également être obtenu par hydrolyse de l’acétate de cyclohexyle à l’aide d’un catalyseur acide ou basique. Cette méthode consiste à cliver la liaison ester dans l’acétate de cyclohexyle pour former du C6H11OH et de l’acide acétique.
- Le réarrangement Beckmann de l’oxime de cyclohexanone utilisant l’acide sulfurique comme catalyseur est une autre méthode pour synthétiser C6H11OH. Ce processus implique la réorganisation du groupe oxime dans la cyclohexanone oxime pour former un intermédiaire amide, qui peut être hydrolysé pour produire du C6H11OH.
Dans l’ensemble, la synthèse de C6H11OH nécessite que les individus effectuent divers processus chimiques et utilisent les précautions de sécurité et les équipements appropriés.
Utilisations du cyclohexanol
Le C6H11OH a de nombreuses applications dans différentes industries.
- Les industries utilisent le C6H11OH comme solvant pour produire des laques, des vernis et des résines, ainsi que comme solvant pour préparer des médicaments dans l’industrie pharmaceutique.
- Le C6H11OH sert d’intermédiaire important dans la production d’acide adipique, un composant nécessaire à la fabrication du nylon. Il agit également comme matière première pour la synthèse de divers produits chimiques, notamment le bisphénol A, la cyclohexanone et le caprolactame.
- L’industrie pétrolière ajoute du C6H11OH comme inhibiteur de corrosion au pétrole brut pour prévenir la corrosion dans les pipelines et les réservoirs de stockage.
- Les fabricants utilisent le C6H11OH pour produire des plastifiants qui améliorent la flexibilité et la durabilité des plastiques. C’est également un ingrédient courant dans les parfums et les cosmétiques.
- Le C6H11OH sert de fluide caloporteur, de lubrifiant et de pesticide. De plus, il sert de réactif dans la synthèse organique et les expériences en laboratoire.
Dans l’ensemble, le C6H11OH a une large gamme d’applications dans diverses industries et ses propriétés polyvalentes en font un produit chimique important dans de nombreux processus industriels.
Des questions:
Le cyclohexanol est-il soluble dans l’eau ?
Le cyclohexanol est modérément soluble dans l’eau, mais sa solubilité diminue à mesure que la température augmente. Il est plus soluble dans les solvants organiques tels que l’éthanol, l’éther diéthylique et l’acétone. La solubilité du C6H11OH dans l’eau est due à la formation de liaisons hydrogène entre le groupe hydroxyle du C6H11OH et les molécules d’eau. Cependant, le cycle cyclohexane hydrophobe du C6H11OH réduit sa polarité globale, le rendant moins soluble dans l’eau que d’autres alcools plus polaires tels que le méthanol et l’éthanol. La solubilité du C6H11OH dans l’eau est une considération importante dans son utilisation comme solvant et dans les processus industriels impliquant l’eau comme milieu.
Laquelle des séries de réactions suivantes convertirait le cyclohexanol en 1,2-époxycyclohexane ?
Pour convertir le cyclohexanol en 1,2-époxycyclohexane, la série de réactions suivantes peut être effectuée :
- Le cyclohexanol est d’abord traité avec un catalyseur acide fort tel que l’acide sulfurique pour former du cyclohexène par déshydratation.
- Le cyclohexène résultant réagit ensuite avec un peracide tel que l’acide m-chloroperbenzoïque (MCPBA) pour former un époxyde, en particulier le 1,2-époxycyclohexane.
Par conséquent, la série correcte de réactions pour convertir le cyclohexanol en 1,2-époxycyclohexane implique une déshydratation du cyclohexanol pour former du cyclohexène suivie d’une époxydation du cyclohexène pour former du 1,2-époxycyclohexane à l’aide d’un peracide.
Pourquoi le cyclohexanol n’a-t-il pas besoin d’un préfixe numérique ?
Le cyclohexanol n’a pas besoin de préfixe numérique dans son nom car il s’agit d’un seul isomère du cyclohexanol. Les isomères sont des molécules ayant la même formule moléculaire mais avec des arrangements structurels d’atomes différents. Le cyclohexanol possède un seul groupe fonctionnel hydroxyle (-OH) attaché à un cycle cyclohexane et sa formule moléculaire est C6H12O. Puisqu’il n’existe qu’une seule disposition possible des atomes dans le cyclohexanol, il ne nécessite pas de préfixe numérique pour préciser sa position ou le nombre de groupes fonctionnels. En revanche, d’autres composés tels que la cyclohexanone et la cyclohexanedione possèdent plusieurs isomères avec différentes positions et nombres de groupes carbonyle et nécessitent donc des préfixes numériques pour spécifier l’emplacement des groupes fonctionnels.
