Le cyanure de sodium est un composé hautement toxique utilisé dans diverses industries. Il libère des ions cyanure qui interfèrent avec la respiration cellulaire, entraînant de graves risques pour la santé, voire la mort.
| Nom UICPA | Le cyanure de sodium |
| Formule moléculaire | NaCN |
| Numero CAS | 143-33-9 |
| Synonymes | Cyanogran, cyanure de sodium, sel de cyanure, sel de cyanure de sodium |
| InChI | InChI=1S/CN.Na/c1-2;/h1H;/q-1;+1 |
Propriétés du cyanure de sodium
Formule de cyanure de sodium
La formule du cyanure de sodium est NaCN. Il se compose d’un cation Na+ et d’un anion CN-. Ce composé chimique est largement utilisé dans divers procédés industriels.
Cyanure De Sodium Masse molaire
La masse molaire du NaCN est calculée en additionnant les masses atomiques de ses éléments constitutifs, le sodium (Na) et le carbone (C) plus l’azote (N). La masse molaire du NaCN est d’environ 49,01 grammes par mole.
Point d’ébullition du cyanure de sodium
Le NaCN a un point d’ébullition d’environ 1 496 degrés Celsius. À cette température, le composé subit un changement de phase d’un liquide à un gaz. Il est essentiel de manipuler le NaCN avec prudence en raison de sa nature toxique.
Cyanure de sodium Point de fusion
Le point de fusion du NaCN est d’environ 564 degrés Celsius. A cette température, le composé solide se transforme à l’état liquide. Des précautions doivent être prises lors de la manipulation du NaCN car il présente de graves risques pour la santé.
Densité du cyanure de sodium g/mL
La densité du NaCN est d’environ 1,6 gramme par millilitre. Cette valeur de densité indique la masse de la substance par unité de volume. La haute densité du NaCN contribue à sa stabilité et facilite son utilisation dans diverses applications.
Cyanure De Sodium Poids moléculaire
Le poids moléculaire du NaCN est d’environ 49,01 grammes par mole. Cette valeur représente la somme des poids atomiques de ses éléments constitutifs. Le poids moléculaire de NaCN est crucial pour déterminer la quantité de composé nécessaire aux réactions chimiques.
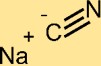
Structure du cyanure de sodium
NaCN a une structure cristalline composée de cations Na+ et d’anions CN-. L’ion cyanure est constitué d’un atome de carbone lié à un atome d’azote. La structure du NaCN joue un rôle important dans sa réactivité et son comportement chimique.
Solubilité du cyanure de sodium
NaCN est hautement soluble dans l’eau, avec une solubilité d’environ 46 grammes pour 100 millilitres à température ambiante. Cette solubilité élevée permet une dissolution et une utilisation efficaces du NaCN dans divers processus.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,6 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 49,01 g/mole |
| Densité | 1,6 g/ml |
| Point de fusion | 564 °C |
| Point d’ébullition | 1496 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, l’ammoniaque, le méthanol, l’éthanol |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Alcalin |
Sécurité et dangers du cyanure de sodium
Le NaCN présente des risques et des dangers importants pour la sécurité en raison de sa nature toxique. L’exposition à ce composé peut entraîner de graves conséquences sur la santé. Il interfère avec la respiration cellulaire, empêchant l’apport d’oxygène aux organes vitaux, ce qui peut entraîner une détresse respiratoire, un arrêt cardiaque et même la mort. L’inhalation ou l’ingestion de NaCN peut provoquer des symptômes rapides et potentiellement mortels. La manipulation du NaCN nécessite une extrême prudence, notamment l’utilisation d’un équipement de protection individuelle (EPI) approprié et le respect des protocoles de sécurité. Il est crucial de stocker, transporter et éliminer correctement le NaCN pour éviter toute libération accidentelle ou contamination. Une formation et une sensibilisation régulières sont essentielles pour minimiser les risques associés au NaCN.
| Symboles de danger | Crâne et os croisés |
| Description de la sécurité | Très toxique |
| Numéros d’identification de l’ONU | ONU 1689 |
| Code SH | 2837.11.00 |
| Classe de danger | 6.1 |
| Groupe d’emballage | je |
| Toxicité | Mortel pour les humains. Il libère du cyanure d’hydrogène, un asphyxiant chimique hautement toxique qui interfère avec la capacité du corps à utiliser l’oxygène. |
Méthodes de synthèse du cyanure de sodium
Il existe plusieurs méthodes de synthèse du NaCN, chacune impliquant la réaction de réactifs appropriés. Une méthode courante est le processus Castner. Dans ce processus, le mélange fondu de carbonate de sodium , de carbone et d’azote gazeux subit un courant électrique, générant du NaCN. Récupérez ensuite le NaCN solidifié.
Dans une autre méthode, l’hydroxyde de sodium réagit avec le gaz HCN. Mélangez de l’eau avec de l’hydroxyde de sodium pour créer une solution et exposez la solution au gaz HCN. Par conséquent, le NaCN et l’eau forment des sous-produits.
De plus, la synthèse de NaCN implique la réaction entre le métal Na et le cyanure d’hydrogène gazeux. Introduisez le gaz dans le sodium métallique, provoquant une réaction vigoureuse qui produit du NaCN et de l’hydrogène gazeux.
Il est important de noter que la synthèse de NaCN ne doit être réalisée que par des professionnels qualifiés dans des installations bien équipées. Le processus nécessite le strict respect des protocoles de sécurité en raison de la nature hautement toxique du composé.
Utilisations du cyanure de sodium
NaCN a diverses applications dans différentes industries en raison de ses propriétés uniques. Voici quelques utilisations courantes :
- Extraction de l’or : L’extraction de l’or utilise largement le NaCN pour extraire les métaux précieux des minerais. Il forme un complexe avec l’or, facilitant la séparation et la purification du métal.
- Placage de métal : les processus de galvanoplastie utilisent du NaCN pour déposer une couche de métal sur les surfaces. Il permet la formation d’un revêtement protecteur et décoratif, améliorant la durabilité et l’apparence.
- Synthèse chimique : NaCN sert de précurseur pour la synthèse de divers composés organiques dans la production de produits pharmaceutiques, de plastiques, de colorants et d’autres produits chimiques.
- Lutte antiparasitaire : NaCN agit comme fumigant pour lutter contre les ravageurs dans certains contextes agricoles. Il élimine les rongeurs et les nuisibles qui peuvent causer des dégâts aux cultures et aux produits stockés.
- Cémentation : NaCN contribue à la cémentation, un processus qui améliore la dureté de surface des objets en acier. Il forme une couche externe dure, améliorant la résistance à l’usure et à la corrosion.
- Fabrication de bijoux : la fabrication de bijoux utilise du NaCN pour le nettoyage, le polissage et la gravure des métaux. Il aide à obtenir les finitions de surface souhaitées et à éliminer les impuretés.
- Recherche en laboratoire : NaCN trouve des applications dans diverses expériences et recherches en laboratoire, notamment dans les domaines de la chimie, de la biochimie et de la métallurgie.
Des questions:
Q : À quoi sert le cyanure de sodium ?
R : NaCN est utilisé dans l’extraction de l’or, le placage de métaux, la synthèse chimique, la lutte antiparasitaire, la cémentation, la fabrication de bijoux et la recherche en laboratoire.
Q : Comment fabriquer du cyanure de sodium ?
R : Le NaCN peut être synthétisé par des méthodes telles que le procédé Castner, la réaction avec l’hydroxyde de sodium et le gaz HCN, ou la réaction du sodium métallique avec le gaz HCN.
Q : Combien y a-t-il d’atomes au total dans 9,203 e-22 moles de cyanure de sodium ?
R : Dans 9,203 e-22 mol de NaCN, le nombre total d’atomes peut être calculé sur la base du nombre d’Avogadro, qui est d’environ 6,022 x 10^23 atomes/mol.
Q : Le cyanure de sodium est-il soluble dans l’eau ?
R : Oui, NaCN est hautement soluble dans l’eau.
Q : Le cyanure de sodium fait-il du Sn2 ?
R : NaCN peut participer aux réactions SN2 (substitution nucléophile bimoléculaire).
Q : Le cyanure de sodium est-il mortel ?
R : Oui, le NaCN est hautement toxique et peut être mortel s’il n’est pas manipulé correctement.
Q : Comment le cyanure de sodium est-il utilisé dans l’exploitation minière ?
R : Le NaCN est utilisé dans l’exploitation minière pour l’extraction de l’or, où il forme un complexe avec l’or, facilitant sa séparation des minerais.
Q : Comment éteindre le cyanure de sodium ?
R : NaCN peut être désactivé en ajoutant un agent de désactivation approprié, tel que du peroxyde d’hydrogène ou de l’hypochlorite de sodium, pour le convertir en substances moins toxiques.
Q : Quel est le principal produit formé lors du traitement du (R) 1-bromo-4-méthylhexane avec du cyanure de sodium ?
R : Le principal produit formé lors du traitement du (R) 1-bromo-4-méthylhexane avec NaCN est le (R) 4-méthylhexanénitrile.
Q : Lequel des éléments suivants réagit le plus lentement avec NaCN ?
R : La réactivité avec NaCN peut varier, mais les halogénures d’alkyle primaires réagissent généralement plus lentement que les halogénures d’alkyle secondaires ou tertiaires.
Q : Le cyanure inhibe-t-il la pompe Na-K ?
R : Oui, le CN inhibe la pompe sodium-potassium, qui est cruciale au maintien d’un bon fonctionnement cellulaire.
