L’oxyde de cuivre (I) est une poudre rouge ou brune de formule chimique Cu2O. Il est utilisé comme pigment, catalyseur et dans les cellules solaires pour ses propriétés semi-conductrices.
| Nom UICPA | Oxyde de cuivre (I) |
| Formule moléculaire | Cu2O |
| Numero CAS | 1317-39-1 |
| Synonymes | Oxyde de cuivre, Cuprite, Oxyde de dicuivre, Delafossite, Monoxyde de cuivre, Sous-oxyde de cuivre |
| InChI | InChI=1S/2Cu.O |
Cu2O masse molaire
La masse molaire de Cu2O est de 143,09 g/mol. Cette valeur est calculée en additionnant les poids atomiques de deux atomes de cuivre (63,55 g/mol x 2) et d’un atome d’oxygène (15,99 g/mol). La masse molaire est une propriété importante d’un composé chimique qui permet de déterminer la quantité de substance présente dans un échantillon donné. Il est également utilisé dans les calculs stœchiométriques pour déterminer la quantité de réactifs nécessaires à une réaction chimique.
Point d’ébullition du Cu2O
Le Cu2O n’a pas de point d’ébullition car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il se décompose en cuivre métallique et en oxygène gazeux. La température de décomposition du Cu2O est d’environ 900°C. Par conséquent, le Cu2O est principalement utilisé comme matériau solide, tel qu’un pigment ou un semi-conducteur.
Point de fusion du Cu2O
Le point de fusion du Cu2O est de 1 232°C. Cette valeur est supérieure à celle de la plupart des métaux et oxydes métalliques. Le Cu2O a un point de fusion élevé en raison de la forte liaison ionique entre les atomes de cuivre et d’oxygène. Le point de fusion élevé rend le Cu2O utile dans les applications à haute température, telles que les émaux céramiques et les matériaux réfractaires.
Densité Cu2O g/ml
La densité du Cu2O est de 6,01 g/cm³. Cette valeur est supérieure à la densité du cuivre métallique (8,96 g/cm³) en raison de la présence d’atomes d’oxygène. La haute densité du Cu2O le rend utile dans diverses applications, comme dans la fabrication de conducteurs électriques et de semi-conducteurs.
Poids moléculaire du Cu2O
Le poids moléculaire du Cu2O est de 143,09 g/mol. Cette valeur est calculée en additionnant les poids atomiques de deux atomes de cuivre et d’un atome d’oxygène. Le poids moléculaire du Cu2O est un paramètre important pour déterminer les propriétés physiques et chimiques du composé. Il est également utilisé dans les calculs stœchiométriques pour déterminer la quantité de réactifs nécessaires à une réaction chimique.
Structure Cu2O
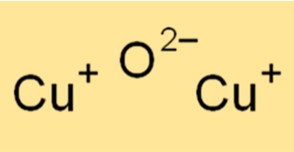
Cu2O a une structure cristalline de forme cubique. La structure cristalline du Cu2O est similaire à celle du sel gemme (NaCl). Le réseau cristallin du Cu2O est composé d’atomes de cuivre coordonnés avec des atomes d’oxygène dans un rapport 1:1. La structure cristalline du Cu2O en fait un matériau utile dans diverses applications, comme la fabrication de semi-conducteurs et de catalyseurs.
Formule d’oxyde de cuivre (I)
La formule chimique de l’oxyde de cuivre (I) est Cu2O. La formule indique que l’oxyde de cuivre (I) est composé de deux atomes de cuivre et d’un atome d’oxygène. La formule de l’oxyde de cuivre (I) est utilisée pour déterminer la stœchiométrie des réactions chimiques impliquant l’oxyde de cuivre (I). Il est également utilisé pour calculer la masse molaire et le poids moléculaire du composé. La formule chimique de l’oxyde de cuivre (I) est importante pour déterminer ses propriétés physiques et chimiques, telles que sa couleur, son point de fusion et sa densité.
| Apparence | Poudre rouge ou brune |
| Gravité spécifique | 6,01 g/cm³ |
| Couleur | Rouge ou marron |
| Odeur | Inodore |
| Masse molaire | 143,09 g/mole |
| Densité | 6,01 g/cm³ |
| Point de fusion | 1 232 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les acides concentrés et l’hydroxyde d’ammonium |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | N’est pas applicable |
| PH | 8,0 – 9,0 (suspension à 10 % dans l’eau) |
Oxyde de cuivre (I) Sécurité et dangers
Le Cu2O est relativement sûr à manipuler, mais il doit être manipulé avec précaution en raison de ses dangers potentiels. C’est un irritant pour les yeux, la peau et le système respiratoire. Le contact direct avec la poudre de Cu2O peut provoquer une irritation cutanée, tandis que l’inhalation de la poudre peut provoquer une irritation respiratoire. C’est également un solide inflammable et peut s’enflammer s’il est exposé à la chaleur ou à une flamme. Le Cu2O peut réagir violemment avec certaines substances, telles que les acides et les halogènes, et libérer des gaz toxiques. Des précautions adéquates doivent être prises lors de la manipulation du Cu2O, comme porter des vêtements de protection et éviter tout contact avec des matériaux incompatibles.
| Symboles de danger | Xn : Nocif |
| Description de la sécurité | S22 : Ne respirez pas la poussière. S36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. S46 : En cas d’ingestion, consulter immédiatement un médecin et lui montrer ce récipient ou cette étiquette. |
| Identifiants ONU | UN3077 |
| Code SH | 28255000 |
| Classe de danger | 9 – Matières dangereuses diverses |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité, mais peut provoquer une irritation des yeux, de la peau et du système respiratoire par contact direct ou par inhalation. |
Méthodes de synthèse de l’oxyde de cuivre (I)
Il existe différentes méthodes pour synthétiser l’oxyde de cuivre (I) (Cu2O), notamment l’oxydation thermique, la précipitation, le dépôt électrochimique et la réduction chimique.
L’oxydation thermique consiste à chauffer le cuivre métallique à haute température en présence d’oxygène ou d’air pour former du Cu2O. Le procédé peut être réalisé au four ou par oxydation à la flamme.
La précipitation implique la réaction de sels de cuivre avec une solution alcaline, telle que l’hydroxyde de sodium, pour former des précipités de Cu2O. Les précipités peuvent être filtrés, lavés et séchés pour obtenir de la poudre de Cu2O.
Le dépôt électrochimique implique l’électrolyse d’une solution de sel de cuivre à l’aide d’une électrode inerte pour déposer du Cu2O sur la surface de l’électrode.
La réduction chimique implique la réduction des ions cuivre à l’aide d’un agent réducteur, tel que le borohydrure de sodium ou l’hydrazine, en présence d’un agent stabilisant, tel que la polyvinylpyrrolidone.
Une autre méthode implique la décomposition thermique du formiate de cuivre en présence d’un agent réducteur, tel que l’urée, pour former du Cu2O.
Chaque méthode de synthèse présente ses avantages et ses inconvénients en termes de rendement, de pureté et d’évolutivité. Il est important de sélectionner soigneusement la méthode appropriée en fonction de l’application prévue et des propriétés souhaitées du Cu2O.
Oxyde de cuivre (I) Utilisations
L’oxyde de cuivre (I) a un large éventail d’applications en raison de ses propriétés uniques, notamment son comportement semi-conducteur, son activité catalytique et ses propriétés antibactériennes. Certaines utilisations courantes du Cu2O incluent :
- Électronique : utilisé comme matériau semi-conducteur de type P dans les appareils électroniques tels que les cellules solaires, les photodétecteurs et les transistors à effet de champ.
- Catalyseur : Utilisé comme catalyseur dans diverses réactions chimiques, telles que l’oxydation du monoxyde de carbone et la réduction des oxydes d’azote.
- Pigment : Utilisé comme pigment rouge dans la céramique, les verres et les émaux.
- Fongicide : Utilisé comme fongicide pour lutter contre les maladies des plantes telles que la brûlure, le mildiou et la rouille.
- Agent antisalissure : utilisé comme agent antisalissure dans les peintures marines pour empêcher la croissance d’organismes marins sur les navires et les structures offshore.
- Agent antibactérien : Possède des propriétés antibactériennes. Utilisé dans des applications médicales telles que les pansements et les revêtements antibactériens.
- Additif : Utilisé comme additif dans l’alimentation animale pour prévenir la carence en cuivre chez le bétail.
La diversité des applications du Cu2O démontre son potentiel en tant que matériau précieux dans diverses industries.
Des questions:
Q : L’oxyde de cuivre (I) est-il dangereux une fois sec ?
R : Le Cu2O n’est pas considéré comme dangereux lorsqu’il est sec, mais il peut être un irritant respiratoire lorsqu’il est inhalé sous forme de poudre.
Q : L’oxyde de cuivre (I) est-il un composé naturel ?
R : Oui, le Cu2O est un composé naturel que l’on retrouve dans certains minéraux, comme la cuprite et la ténorite.
Q : Qu’est-ce qui dissout l’oxyde de cuivre (I) ?
R : Cu2O est insoluble dans l’eau et dans la plupart des solvants organiques. Il peut être dissous dans des acides forts, tels que l’acide chlorhydrique, et dans des solutions d’ammoniaque ou de cyanure de potassium.
Q : Quelle est la méthode chimique pour créer une couche d’oxyde de cuivre (I) sur du cuivre métallique ?
R : Une méthode chimique pour créer une couche de Cu2O sur du cuivre métallique consiste à immerger le cuivre dans une solution de sulfate de cuivre et de chlorure de sodium, puis à chauffer le cuivre à l’air pour oxyder la surface.
Q : Comment le cuivre peut-il être extrait de l’oxyde de cuivre (I) ?
R : Le cuivre peut être extrait du Cu2O en chauffant le composé avec du carbone ou un autre agent réducteur pour réduire le Cu2O en cuivre métallique.
Q : Combien de moles de cuivre seraient nécessaires pour fabriquer 1 mole de Cu2O ?
R : 2 moles de cuivre seraient nécessaires pour fabriquer 1 mole de Cu2O.
Q : Qu’est-ce que le Cu2O ?
R : Cu2O est la formule chimique de l’oxyde de cuivre (I), une poudre rouge ou rouge brunâtre qui est un oxyde de cuivre.
Q : Que se passe-t-il lorsque de l’oxyde de cuivre (I) est présent sur une surface en cuivre ?
R : Lorsque de l’oxyde de cuivre (I) est présent sur une surface en cuivre, il peut agir comme une couche protectrice contre une oxydation et une corrosion supplémentaires du cuivre métallique.
