Le sulfure de cuivre (I) (Cu2S) est un composé solide noir. Il est utilisé comme semi-conducteur de type P et comme catalyseur dans diverses applications industrielles telles que les cellules solaires et la production d’hydrogène.
| Nom UICPA | Sulfure de cuivre(1+) |
| Formule moléculaire | Cu2S |
| Numero CAS | 22205-45-4 |
| Synonymes | Monosulfure de cuivre, sulfure de cuivre, sulfure de cuivre (1+), sulfure de cuivre, sulfure cuivrique, sulfure cuivreux |
| InChI | InChI=1S/2Cu.S/q2*+1;-2 |
Masse molaire du sulfure de cuivre(I)
Le sulfure de cuivre (I) a une masse molaire de 159,16 g/mol. La masse molaire est la masse d’une mole d’une substance, calculée en additionnant les masses atomiques des éléments présents dans le composé. Le sulfure de cuivre (I) est composé de deux atomes de cuivre et d’un atome de soufre, chacun avec sa masse atomique respective. Connaître la masse molaire est important dans divers calculs chimiques, tels que déterminer la quantité d’une substance nécessaire pour une réaction particulière ou trouver la formule empirique d’un composé.
Point d’ébullition du sulfure de cuivre (I)
Le sulfure de cuivre (I) a un point de fusion élevé de 1 103 °C, mais il n’a pas de point d’ébullition distinct. En effet, lorsqu’il est chauffé à des températures élevées, le sulfure de cuivre (I) se décompose au lieu de bouillir. La décomposition du sulfure de cuivre (I) conduit à la formation de gaz de cuivre et de sulfure de cuivre, qui peuvent ensuite être collectés et analysés. L’absence de point d’ébullition pour le sulfure de cuivre (I) n’est pas inhabituelle pour de nombreux composés solides qui se décomposent sous l’effet du chauffage.
Point de fusion du sulfure de cuivre (I)
Le sulfure de cuivre (I) a un point de fusion de 1 103 °C. Le point de fusion élevé est dû à la forte liaison ionique entre les atomes de cuivre et de soufre dans la structure du réseau cristallin du composé. Le point de fusion élevé du sulfure de cuivre (I) le rend utile dans les applications à haute température, comme dans les cellules solaires, où il agit comme un semi-conducteur de type p.
Densité du sulfure de cuivre(I) g/ml
Le sulfure de cuivre (I) a une densité de 5,6 g/mL. La densité d’une substance est la masse d’une substance par unité de volume. La haute densité du sulfure de cuivre (I) est due aux atomes lourds présents dans le composé, ainsi qu’à sa structure cristalline. La haute densité du sulfure de cuivre (I) le rend utile dans diverses applications, notamment comme pigment dans la céramique et le verre.
Poids moléculaire du sulfure de cuivre (I)
Le poids moléculaire du sulfure de cuivre (I) est de 159,16 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Le sulfure de cuivre (I) a une formule chimique simple composée de deux atomes de cuivre et d’un atome de soufre, son poids moléculaire est donc relativement facile à calculer. Le poids moléculaire d’un composé est important dans divers calculs chimiques, tels que la détermination de la stœchiométrie d’une réaction ou la recherche de la formule moléculaire d’un composé.
Structure du sulfure de cuivre (I)
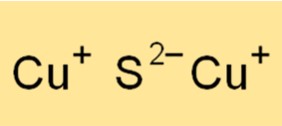
Le sulfure de cuivre (I) a une structure de réseau cristallin cubique à faces centrées (fcc). La structure cristalline est composée d’atomes de cuivre et de soufre, chaque atome de cuivre étant entouré de quatre atomes de soufre disposés dans un arrangement tétraédrique. La forte liaison ionique entre les atomes de cuivre et de soufre donne lieu à une structure cristalline stable avec un point de fusion élevé. La structure cristalline du sulfure de cuivre (I) est importante pour comprendre ses propriétés physiques et chimiques, ainsi que ses diverses applications.
Formule de sulfure de cuivre (I)
La formule chimique du sulfure de cuivre (I) est Cu2S, ce qui indique que le composé est composé de deux atomes de cuivre et d’un atome de soufre. La formule d’un composé fournit des informations sur les éléments présents et le nombre d’atomes de chaque élément du composé. La formule du sulfure de cuivre (I) est utile dans divers calculs chimiques, tels que la détermination du rapport molaire du cuivre et du soufre dans le composé ou la recherche de la formule empirique du composé.
| Apparence | Noir solide |
| Gravité spécifique | 5,6 g/ml |
| Couleur | Noir |
| Odeur | Inodore |
| Masse molaire | 159,16 g/mole |
| Densité | 5,6 g/ml |
| Point de fusion | 1 103 °C |
| Point d’ébullition | Se décompose en chauffant |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Insoluble dans l’eau et les solvants organiques |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sulfure de cuivre (I) (Cu2S) Sécurité et dangers
Le sulfure de cuivre (I) (Cu2S) est généralement considéré comme étant sans danger pour la manipulation, car il s’agit d’un composé solide stable et non réactif. Cependant, comme tous les produits chimiques, il doit être manipulé avec précaution pour éviter toute exposition accidentelle. L’inhalation de poussières ou de vapeurs provenant du composé doit être évitée, car cela peut provoquer une irritation du système respiratoire. Le contact cutané avec le sulfure de cuivre (I) (Cu2S) peut également provoquer une irritation ou des réactions allergiques. C’est pourquoi des gants et d’autres vêtements de protection doivent être portés lors de sa manipulation. En cas d’ingestion accidentelle, des soins médicaux doivent être immédiatement recherchés. Des procédures appropriées de manipulation, de stockage et d’élimination doivent être suivies pour prévenir les risques environnementaux.
| Symboles de danger | Aucun |
| Description de la sécurité | Évitez l’inhalation et le contact avec la peau. Portez des vêtements de protection. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 284290 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse du sulfure de cuivre (I) (Cu2S)
Il existe plusieurs méthodes pour synthétiser le sulfure de cuivre (I) (Cu2S), notamment :
- Méthode de synthèse directe : elle consiste à faire réagir de la poudre de cuivre avec du soufre à haute température dans une atmosphère inerte pour former du sulfure de cuivre (I).
- Méthode solvothermique : elle consiste à chauffer un mélange d’acétate de cuivre et de thiourée dans un solvant à des températures et des pressions élevées pour former des particules de sulfure de cuivre (I).
- Méthode hydrothermale : elle consiste à faire réagir des sels de cuivre et du soufre dans une solution aqueuse à des températures et des pressions élevées pour former du sulfure de cuivre (I).
- Méthode de dépôt chimique en phase vapeur : elle consiste à décomposer un précurseur contenant du cuivre dans un environnement gazeux contenant du soufre pour former des films de sulfure de cuivre (I).
- Méthode de pyrolyse par pulvérisation : elle consiste à pulvériser une solution contenant des sels de cuivre et du soufre sur un substrat chauffé pour former un mince film de sulfure de cuivre (I).
- Méthode de co-précipitation : elle consiste à précipiter simultanément les ions cuivre et soufre dans une solution aqueuse en utilisant un agent précipitant approprié pour former du sulfure de cuivre (I).
- Méthode électrochimique : elle consiste à utiliser une cellule électrochimique pour déposer du sulfure de cuivre (I) sur un substrat à partir d’une solution contenant des ions cuivre et soufre.
Ces méthodes offrent différents degrés de contrôle sur la taille, la forme et les propriétés des particules ou des films de sulfure de cuivre (I) résultants, ce qui les rend utiles pour différentes applications.
Sulfure de cuivre (I) (Cu2S)
Le sulfure de cuivre (I) (Cu2S) est un composé utile avec diverses applications dans différents domaines. Voici quelques-unes de ses utilisations :
- Cellules photovoltaïques : Utilisées dans la fabrication de cellules photovoltaïques. Les cellules photovoltaïques sont utilisées pour produire de l’électricité.
- Pigments : Utilisés comme pigment dans la fabrication de divers produits, notamment la céramique, le verre et les plastiques. Il offre une couleur noire profonde qui résiste à la décoloration et aux intempéries.
- Lubrifiants : Utilisé comme lubrifiant dans diverses applications en raison de son faible coefficient de friction. Il est particulièrement utile dans les environnements à haute température et haute pression.
- Semi-conducteurs : utilisés comme matériau semi-conducteur dans les applications électroniques et optoélectroniques. Il possède des propriétés optiques et électroniques uniques qui le rendent adapté à diverses applications, notamment les cellules photovoltaïques, les capteurs et les détecteurs.
- Fongicides : Utilisé comme fongicide en agriculture pour protéger les cultures contre les maladies fongiques. C’est une alternative efficace et écologique aux fongicides chimiques traditionnels.
- Pigments inorganiques : Utilisés dans la fabrication de pigments inorganiques. Ces pigments sont utilisés dans la production de verre coloré, de céramiques et d’émaux. Sa couleur noire profonde résiste à la décoloration et aux intempéries, ce qui en fait un choix populaire pour les pigments longue durée.
Des questions:
Q : Qu’est-ce que le Cu2S ?
R : Cu2S est la formule chimique du sulfure de cuivre (I), un composé de sulfure de cuivre couramment utilisé dans diverses applications, notamment les cellules photovoltaïques, les pigments, les semi-conducteurs et les fongicides.
Q : Que donnera le chauffage d’un mélange de Cu2O et de Cu2S ?
R : Chauffer un mélange de Cu2O et de Cu2S donnera un mélange de gaz de cuivre et de dioxyde de soufre, ainsi que tout Cu2O ou Cu2S n’ayant pas réagi qui reste.
Q : Quel est le nom du composé Cu2S ? R : Le nom du composé Cu2S est sulfure de cuivre (I).
