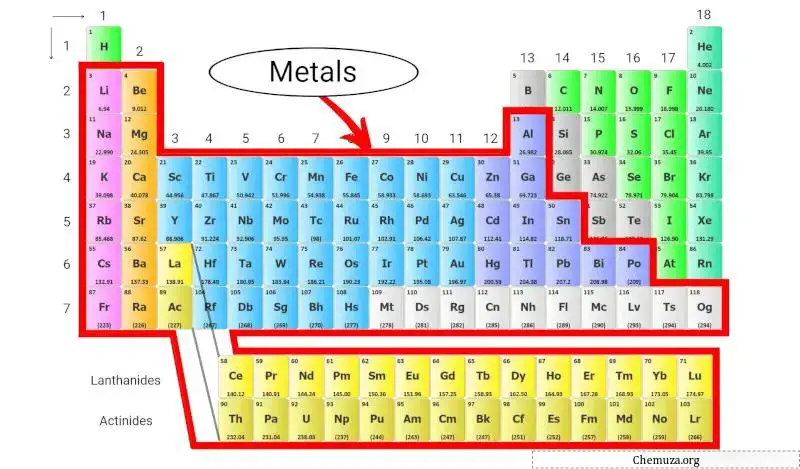
元素周期表中的金属是我们周围随处可见的重要元素,从我们口袋里的硬币到为我们家庭供电的电线。事实上,元素周期表上的大多数元素都是金属!
它们具有一些共同的特性,例如有光泽、热和电的良好导体以及可延展性(意味着它们可以弯曲或成形而不会断裂)。 [1]
让我们更多地了解金属和元素周期表中发现的不同类型的金属。
金属到底是什么?
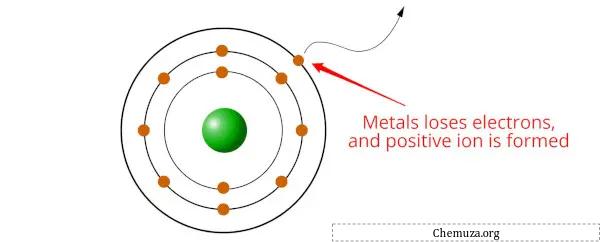
金属是在发生化学反应时容易失去电子并形成阳离子(带正电的离子)的元素。
但你知道为什么会发生这种情况吗?
这是因为金属的电离能较低,这意味着从金属原子中除去电子所需的能量相对较少。当金属原子失去一个或多个电子时,它就变成带正电荷的阳离子。
金属往往会失去电子以获得更稳定的电子构型,通常是通过获得稳定的八位组(即最外层有8个电子)。
现在让我们看看元素周期表中分类的不同类型的金属。
碱金属
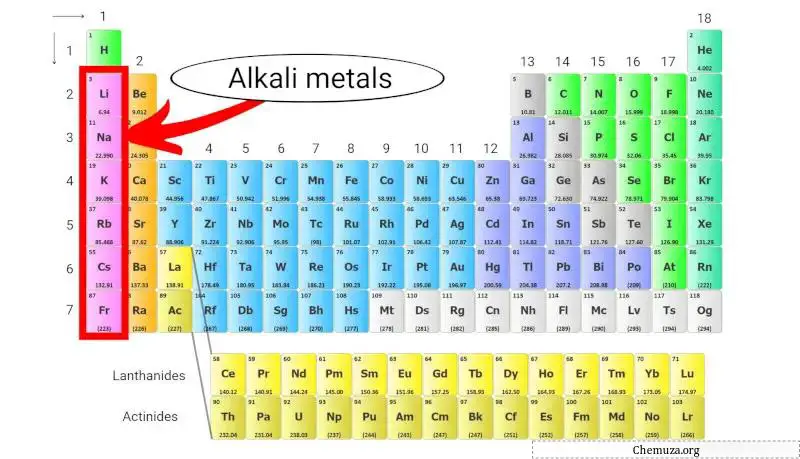
碱金属是元素周期表中的一组元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs) 和钫(Fr)。
它们属于元素周期表第 1 族,也称为“碱金属族”。
碱金属由于其低电离能而非常活泼,使得它们更有可能失去单价电子以形成带+1电荷的阳离子。 [2]
了解更多:元素周期表中的碱金属。
碱土金属
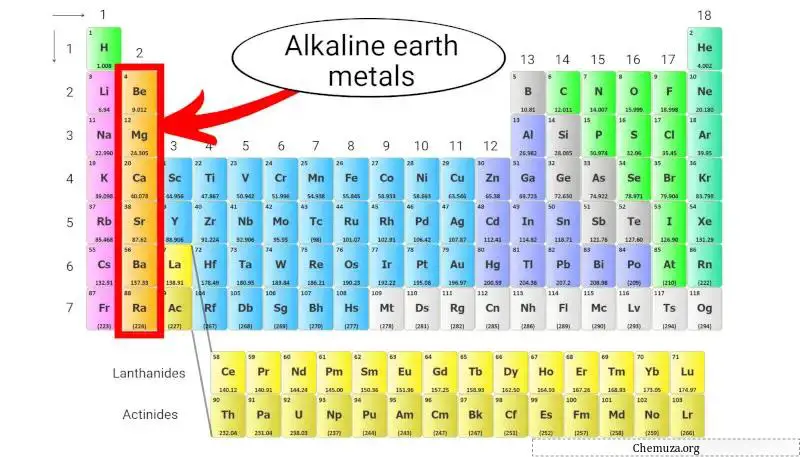
碱土金属是元素周期表中的一组元素,由铍 (Be)、镁 (Mg)、钙 (Ca)、锶 (Sr)、钡 (Ba) 和镭 (Ra) 组成。
它们属于元素周期表第 2 族,也称为“碱土金属族”。
碱土金属的反应性比碱金属低,但它们仍然具有相对较低的电离能,并且倾向于形成带+2电荷的阳离子。 [3]
了解更多:元素周期表中的碱土金属。
过渡金属
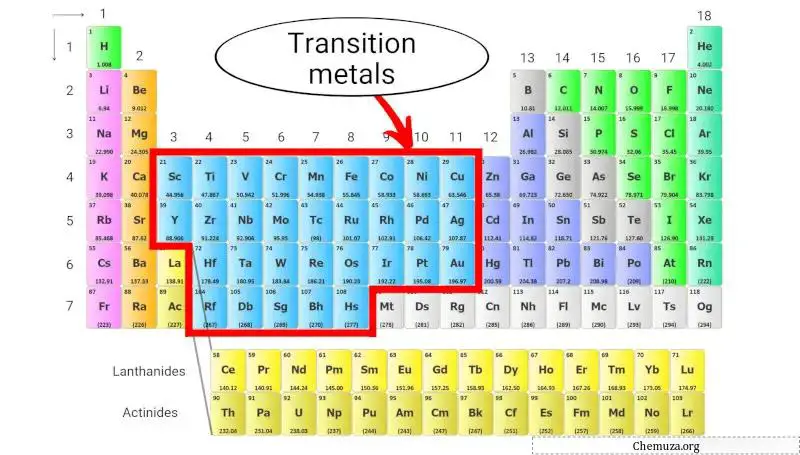
过渡金属是一组位于元素周期表中心的金属元素,占据第 3 族至第 11 族(见上图)。
它们的特点是形成有色化合物的能力、 多种氧化态以及相对较高的密度和熔点。
过渡金属以其化学反应活性而闻名,许多过渡金属用作化学反应的催化剂。它们还用于各种应用,例如钢铁和其他合金、电子产品和电池的生产。
了解更多:元素周期表中的过渡金属。
内部过渡金属
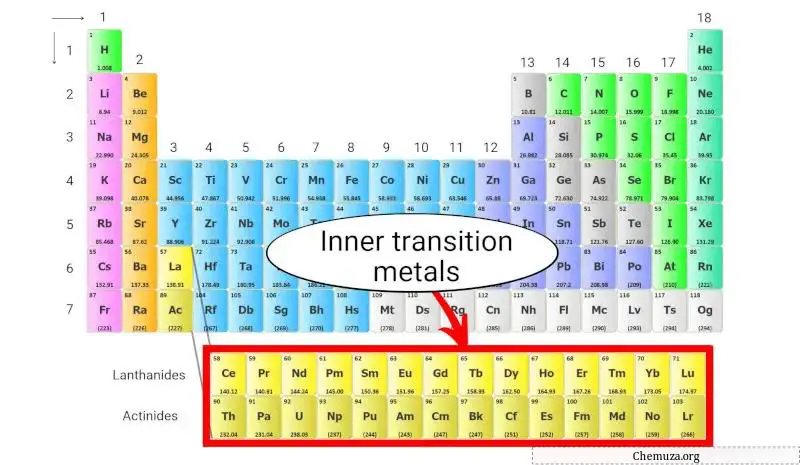
内部过渡金属是位于元素周期表底部、表主体下方的一组金属元素。
它们分为两个亚组:
- 镧系元素和
- 锕系元素。
内部过渡金属的电子构型是独特的,电子填充其原子的 f 轨道。这导致了独特的电子和磁性特性,使其在各种技术应用中非常有用。
了解更多:元素周期表的内部过渡金属。
稀土金属
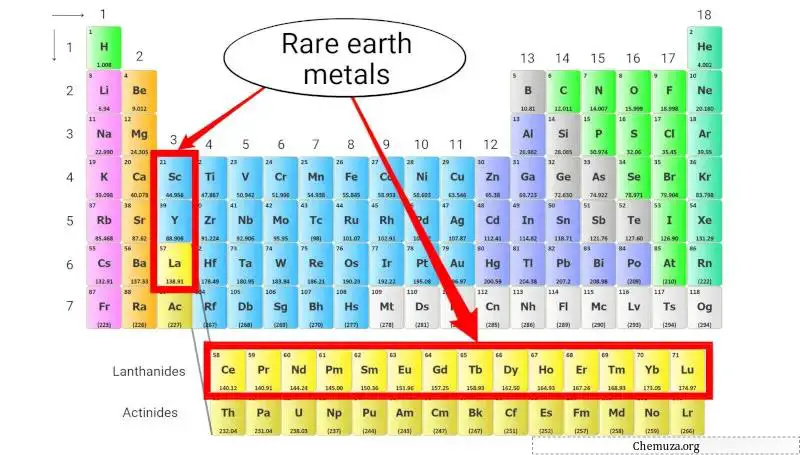
稀土金属,也称为稀土元素,是一组金属元素,包括镧系元素(原子序数 57 至 71)、钪 (Sc) 和钇 (Y)。
尽管名称如此,稀土金属实际上并不稀有,但由于其浓度低且化学性质相似,从矿石中提取它们非常困难且昂贵。 [4]
重金属
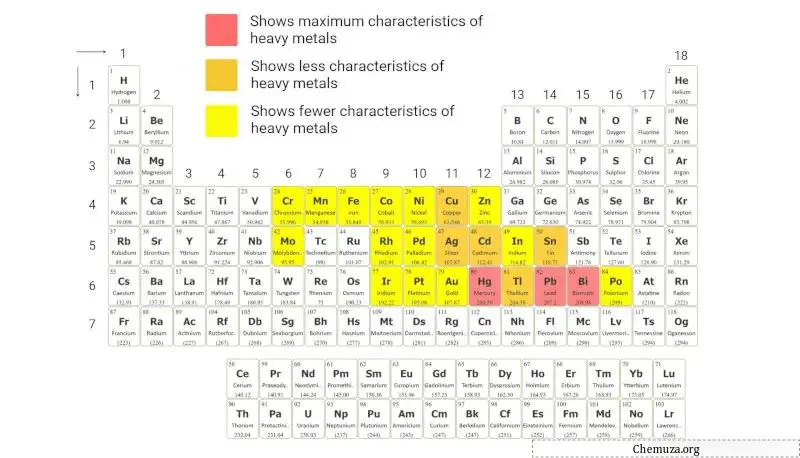
重金属是一组具有相对较高原子质量和密度的金属元素。
重金属通常以其高密度为标准来识别,通常大于5克/立方厘米。
上面的元素周期表根据这种分类提供了这些元素的直观表示。
了解更多:元素周期表中的重金属。
概括
金属是在发生化学反应时容易失去电子并形成阳离子的元素。它们的电离能较低,因此更有可能失去电子并变成带正电的离子。
元素周期表包含多种金属,包括碱金属、碱土金属、过渡金属、内过渡金属、稀土金属和重金属。
碱金属的反应性很强,而碱土金属的反应性较低。过渡金属以其形成彩色化合物和多种氧化态的能力而闻名,并且内部过渡金属具有独特的电子和磁性。稀土金属的提取困难且昂贵,而重金属的密度很高。
