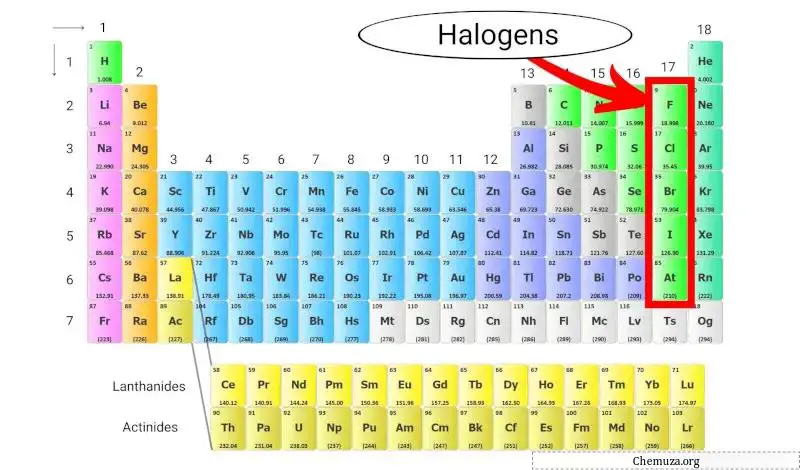
卤素是元素周期表第 17 族(也称为卤素族)中的一组元素。卤素包括五种不同的元素:氟(F)、氯(Cl)、溴(Br)、碘(I) 和砹(At)。
卤素是独特的,因为它们是唯一能够与周期表上所有其他元素形成化合物的元素。
让我们进一步探讨卤素。
什么是卤素?为什么他们这么叫?
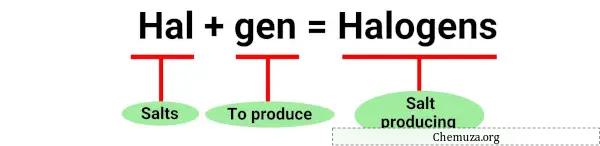
“卤素”一词源自希腊语“halos”,意思是盐,“genes”意思是生产者。 [1]
事实上,卤素最初是通过其与金属反应时产生盐的能力而被发现的。
例如:
当氯 (Cl 2 ) 与钠(Na) 反应时,会形成氯化钠 (NaCl),这是一种常见的食盐:
2Na + Cl2 → 2NaCl
同样,当溴 (Br 2 ) 与钾 (K) 反应时,会形成溴化钾 (KBr):
2K + Br2 → 2KBr
这些反应是卤素与金属反应时产生盐的例子,因此得名“卤素”。
元素周期表中最活泼的卤素
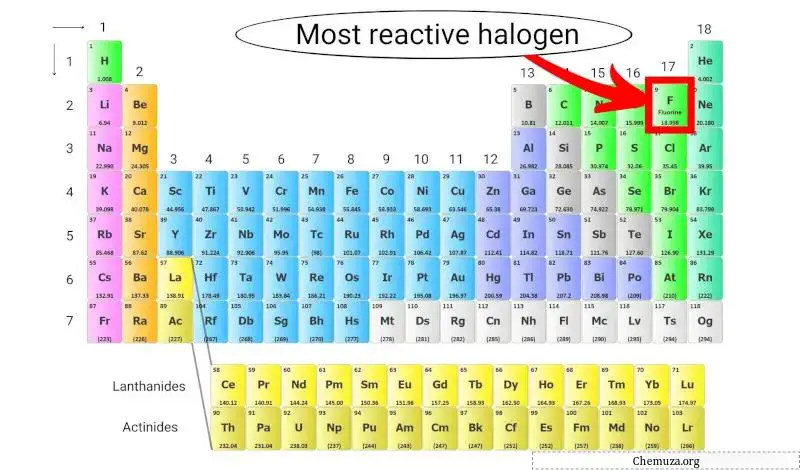
氟是最活泼的卤素,因为它在元素周期表中所有元素中具有最高的电负性,这意味着它对电子具有很强的吸引力。
这使得它非常活泼,能够与元素周期表上的几乎所有其他元素反应形成化合物。 [2]
简而言之,氟就像一块电子磁铁,它会尽其所能地获得电子并完成其外壳。
它通过与其他元素发生反应并窃取它们的电子形成新的化合物来实现这一点。
这就是为什么氟如此活跃,以及为什么它在自然界中从未以元素形式存在,而总是以化合物形式存在。
由于其高反应性,氟化物也极其危险并且使用起来不安全。
它通常在专业实验室中处理,并用于工业过程中生产各种化学品和材料。
卤素的反应性
卤素由于其较高的电负性而具有很强的反应性,这意味着它们具有非常高的吸引电子的能力。
此外,卤素的最外层有7个电子,它们只需要一个额外的电子来填充它并达到像惰性气体一样稳定的电子构型。
例如,您可以看到氟的玻尔图在其最外层有 7 个电子。
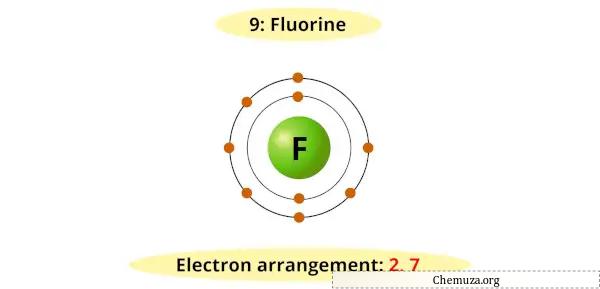
现在需要 1 个额外的电子才能获得稳定的八位字节 (7 + 1 = 8)。
卤素与金属反应形成称为金属卤化物的离子化合物,它可以产生明亮、多彩的火焰。
它们还与氢、硫和氮等非金属发生反应,形成一系列共价化合物。 [3]
因此,卤素获得电子并获得稳定的惰性气体构型的倾向使得它们非常活泼并且能够与其他元素形成化合物。
卤素的周期性趋势
当我们向下移动族时,卤素元素的物理性质和化学性质都表现出变化。
让我们看看卤素的一些特性的趋势。
- 原子尺寸:随着族群的深入,卤素的原子尺寸增加。这是因为每个卤素比它上面的能级多一个能级,这意味着最外层的电子距离原子核更远。
- 电负性:当一个元素向下移动时,卤素元素的电负性降低。这意味着位于该族顶部的卤素(如氟和氯)的电负性更大,因此比位于底部的卤素(如碘和砹)更容易吸引电子。
- 熔点和沸点:随着族群的向下移动,卤素的熔点和沸点增加。事实上,较大的原子具有更多的电子,并且能够形成更强的分子间力。 [4]
- 对金属的反应性:随着族群向下移动,卤素对金属的反应性降低。这意味着位于该族顶部的卤素(如氟和氯)比位于底部的卤素(如碘和砹)更容易与金属发生反应。
概括
卤素是元素周期表第 17 族中的五种元素(氟、氯、溴、碘和砹)。它们具有与所有其他元素形成化合物的独特能力。
卤素由于其高电负性和获得电子以实现稳定的惰性气体构型的倾向而具有很强的反应性。由于其高电负性,氟是最具反应性的卤素。
当卤素在族中向下移动时,其物理和化学性质会发生变化,例如原子尺寸增加、电负性降低以及熔点和沸点增加。卤素对金属的反应性也会随着族群的向下移动而降低。
