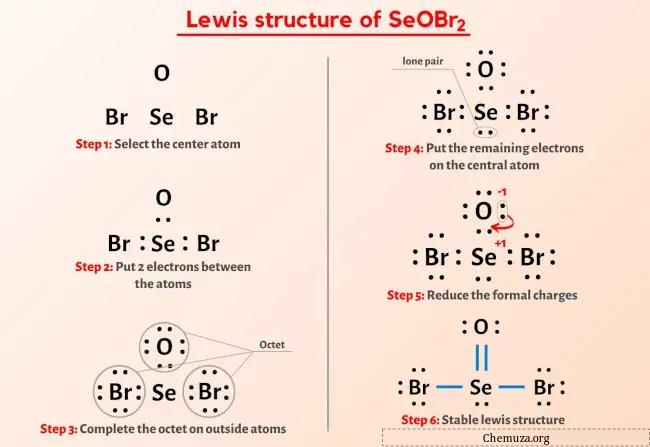
所以你已经看过上面的图片了,对吧?
让我简单解释一下上图。
SeOBr2 路易斯结构的中心有一个硒 (Se) 原子,周围有两个溴 (Br) 原子和一个氧 (O) 原子。硒 (Se) 和氧 (O) 原子之间存在双键,硒 (Se) 和溴 (Br) 原子之间存在单键。
如果您对上图中 SeOBr2 的路易斯结构没有理解任何内容,那么请跟随我,您将获得有关绘制SeOBr2的路易斯结构的详细逐步说明。
那么让我们继续绘制 SeOBr2 的路易斯结构的步骤。
绘制 SeOBr2 Lewis 结构的步骤
步骤 1:找出 SeOBr2 分子中的价电子总数
为了找到 SeOBr2 分子中的价电子总数,您首先需要知道硒原子、氧原子以及溴原子中存在的价电子。
(价电子是存在于任何原子最外层轨道的电子。)
在这里我将告诉您如何使用元素周期表轻松找到硒、氧和溴的价电子。
SeOBr2 分子中的总价电子
→ 硒原子给出的价电子:
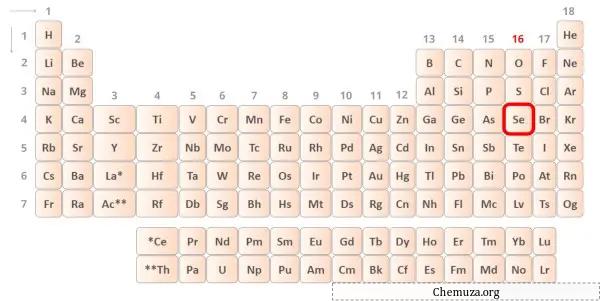
硒是元素周期表第 16 族的元素。 [1]因此,硒中存在的价电子为6 。
您可以看到硒原子中存在 6 个价电子,如上图所示。
→ 氧原子给出的价电子:

氧是元素周期表第 16 族的元素。 [2]因此,氧中存在的价电子为6 。
您可以看到氧原子中存在 6 个价电子,如上图所示。
→ 溴原子给出的价电子:
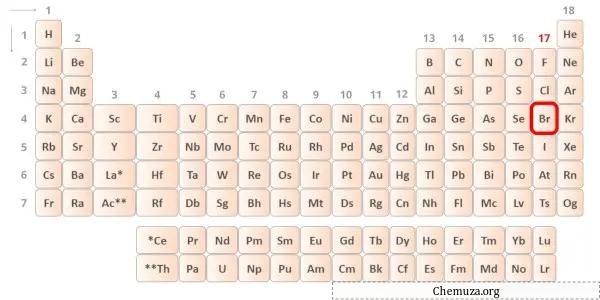
溴是元素周期表第 17 族的元素。 [3]因此,溴中存在的价电子为7 。
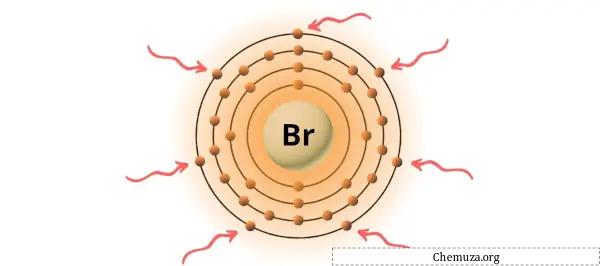
您可以看到溴原子中存在 7 个价电子,如上图所示。
所以,
SeOBr2 分子中的总价电子= 1 个硒原子贡献的价电子 + 1 个氧原子贡献的价电子 + 2 个溴原子贡献的价电子 = 6 + 6 + 7(2) = 26 。
第二步:选择中心原子
为了选择中心原子,我们必须记住电负性最小的原子保留在中心。
现在这里给定的分子是SeOBr2,包含硒原子(Se)、氧原子(O)和溴原子(Br)。
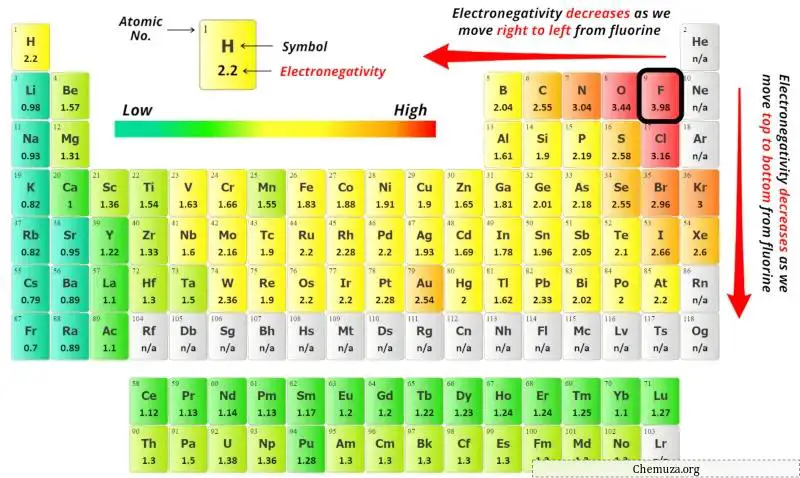
您可以在上面的元素周期表中看到硒(Se)原子、氧(O)原子和溴(Br)原子的电负性值。
如果我们比较硒原子(Se)、氧原子(O)和溴原子(Br)的电负性值,那么硒原子的电负性较小。
这里,硒原子是中心原子,氧原子和溴原子是外部原子。
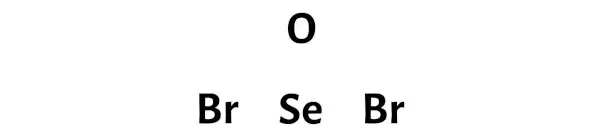
第三步:通过在原子之间放置一对电子来连接每个原子
现在,在 SeOBr2 分子中,您需要将电子对放置在硒 (Se) 和氧 (O) 原子之间以及硒 (Se) 和溴 (Br) 原子之间。
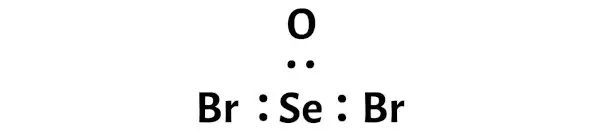
这表明这些原子在 SeOBr2 分子中彼此化学键合。
第四步:使外部原子稳定。将剩余的价电子对放在中心原子上。
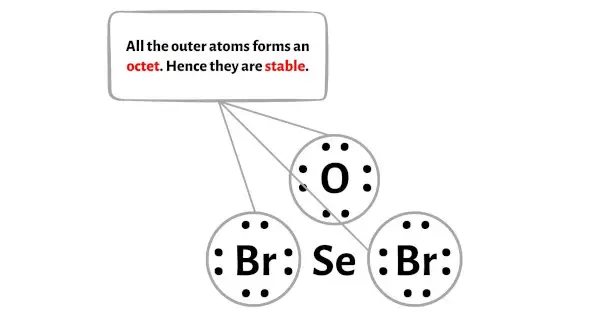
在此步骤中,您需要检查外部原子的稳定性。
在 SeOBr2 分子的示意图中,您可以看到外部原子是氧原子和溴原子。
这些氧和溴原子形成八位组,因此是稳定的。
此外,在步骤 1 中,我们计算了 SeOBr2 分子中存在的价电子总数。
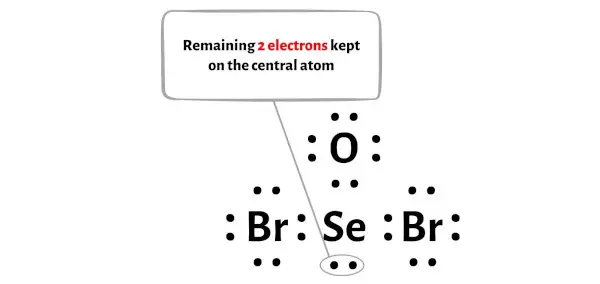
SeOBr2 分子共有26 个价电子,上图中仅使用了其中的24 个价电子。
因此剩余电子数 = 26 – 24 = 2 。
您需要将这2 个电子放置在上图中 SeOBr2 分子的中心硒原子上。
现在让我们继续下一步。
第 5 步:检查中心原子上的八位字节
在此步骤中,您需要检查中心硒 (Se) 原子是否稳定。
为了检查中心硒(Se)原子的稳定性,我们需要检查它是否形成八位组。
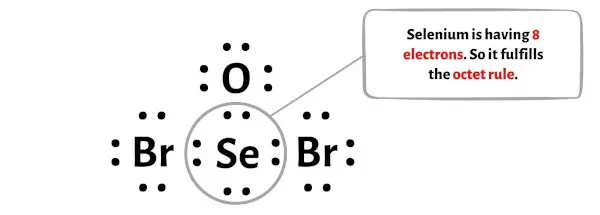
您可以在上图中看到硒原子形成一个八位组。这意味着它有 8 个电子。
因此中心硒原子是稳定的。
现在让我们进行最后一步,检查 SeOBr2 的路易斯结构是否稳定。
第6步:检查路易斯结构的稳定性
现在您已完成最后一步,您需要检查 SeOBr2 路易斯结构的稳定性。
路易斯结构的稳定性可以使用形式电荷概念来验证。
简而言之,我们现在必须找到 SeOBr2 分子中硒 (Se)、氧 (O) 和溴 (Br) 原子上的形式电荷。
要计算正式税,您必须使用以下公式:
形式电荷 = 价电子 – (键合电子)/2 – 非键合电子
您可以在下图中看到 SeOBr2 分子每个原子的键合电子和非键合电子数量。
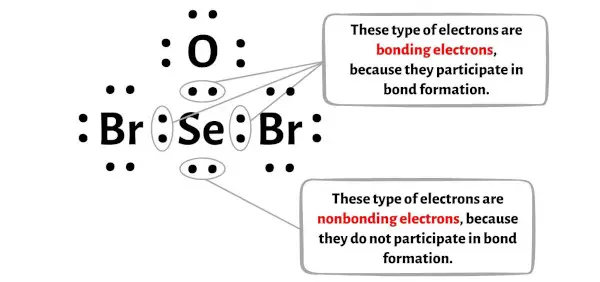
对于硒 (Se) 原子:
价电子 = 6(因为硒属于第 16 族)
键合电子 = 6
非键合电子 = 2
对于氧原子 (O):
价电子 = 6(因为氧位于第 16 族)
键合电子 = 2
非键合电子 = 6
对于溴原子 (Br):
价电子 = 7(因为溴属于第 17 族)
键合电子 = 2
非键合电子 = 6
| 正式指控 | = | 价电子 | – | (结合电子)/2 | – | 非键合电子 | ||
| 硒 | = | 6 | – | 6/2 | – | 2 | = | +1 |
| 哦 | = | 6 | – | 2/2 | – | 6 | = | -1 |
| 溴 | = | 7 | – | 2/2 | – | 6 | = | 0 |
从上面的正式电荷计算中,您可以看到硒 (Se) 原子的电荷为+1 ,氧 (O) 原子的电荷为-1 。
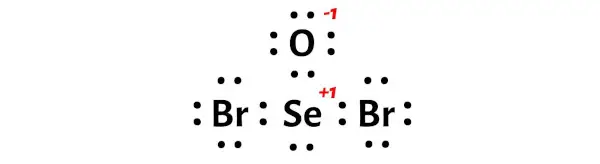
因此,上述得到的SeOBr2的Lewis结构并不稳定。
因此,必须通过将电子对移向硒原子来最小化这些电荷。
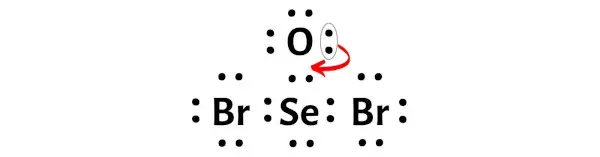
将电子对从氧原子移动到硒原子后,SeOBr2 的路易斯结构变得更加稳定。
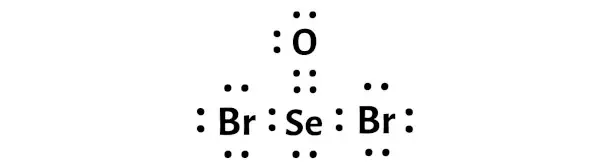
在上述 SeOBr2 的路易斯点结构中,您还可以将每对成键电子 (:) 表示为单键 (|)。这样做将产生以下 SeOBr2 的路易斯结构。
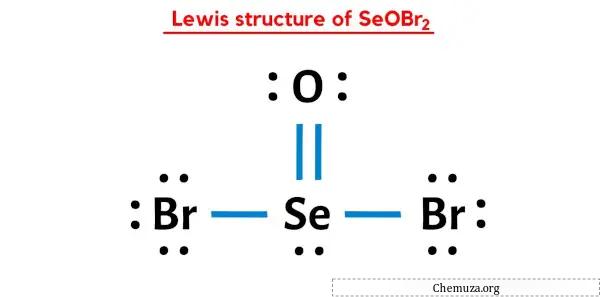
我希望您已经完全理解上述所有步骤。
为了进行更多练习和更好地理解,您可以尝试下面列出的其他路易斯结构。
尝试(或至少查看)这些路易斯结构以更好地理解:
