氟甲烷(CH3F)是一种无色气体,具有轻微的醚味。它用于电子产品、药品的生产以及用作制冷剂。它的毒性不是很大,但会构成强大的温室气体。
| 国际纯粹和应用化学联合会名称 | 氟甲烷 |
| 分子式 | 氟化氢 |
| CAS 号 | 593-53-3 |
| 同义词 | 氟化甲烷、氟利昂 41、卤化碳 41、R 41、UN 2452 |
| 乙酰胆碱 | InChI=1S/CH3F/c1-2/h1H3 |
氟甲烷的性质
CH3F 沸点
CH3F的沸点为-78.4℃,较低。这使其成为制冷和空调系统等各种应用的理想制冷剂。由于其沸点较低,CH3F 也可用作气溶胶中的推进剂。
CH3F 摩尔质量
CH3F是一种化合物,分子式为CH3F。它也称为氟甲烷,摩尔质量为 34.03 g/mol。 CH3F是一种无色气体,具有轻微的醚味,由于其独特的性质而被广泛应用于各种应用。
CH3F 熔点
CH3F的熔点为-141℃,也是比较低的。它的低熔点使其易于处理和运输,使其成为各种工业应用的热门选择。 CH3F 的低熔点也使其适合在低温应用中用作制冷剂。
密度 CH3F
CH3F的密度为0.89g/ml,相对较低。这使得它的密度低于空气,空气的密度为 1.29 克/毫升。因此,CH3F 通常在各种应用中用作比空气轻的气体,包括泄漏检测、气相色谱法以及用作气球和飞艇的升力气体。
CH3F 分子量
CH3F的分子量为34.03 g/mol,相对较低。这使其成为一种易于处理和运输的轻质化合物。 CH3F因其低分子量和独特的性质而常用于电子和药品的生产。
CH3F的结构
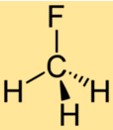
CH3F的结构由与三个氢原子和一个氟原子键合的单个碳原子组成。氟原子连接到碳原子上,取代了甲烷中的一个氢原子。 CH3F的结构使其成为一种具有独特化学性质的稳定化合物。
氟甲烷分子式
氟代甲烷的分子式为CH3F,代表分子中原子的排列。该式表明氟代甲烷由1个碳原子、3个氢原子和1个氟原子组成。该公式用于描述氟代甲烷的化学成分,在各种应用中都很重要。
| 外貌 | 无色气体 |
| 比重 | 20°C 时为 0.89(空气 = 1) |
| 颜色 | 无色 |
| 闻 | 淡淡的空灵气味 |
| 摩尔质量 | 34.03克/摩尔 |
| 密度 | 0.89克/毫升 |
| 融合点 | -141℃ |
| 沸点 | -78.4℃ |
| 闪点 | 非易燃 |
| 水中溶解度 | 20°C 时为 0.5 克/升 |
| 溶解度 | 与有机溶剂混溶 |
| 蒸汽压力 | 20°C 时为 4.4 巴 |
| 蒸气密度 | 1.43(空气=1) |
| 酸度 | 50.9 |
| 酸碱度 | 不适用 |
氟甲烷的安全性和危险性
氟甲烷通常被认为是一种处理和使用安全的化合物,毒性低且不易燃。然而,与任何化学品一样,它也存在潜在危险和安全考虑。接触高浓度的氟甲烷会导致头晕、头痛和恶心。它也是一种导致气候变化的强大温室气体。氟甲烷应在通风良好的区域处理,并佩戴防护装备,例如手套和护目镜。遵循正确的储存和处理程序非常重要,以避免泄漏和意外释放到环境中。
| 危险符号 | F+ |
| 安全说明 | 高度易燃气体;吸入有毒;引起皮肤刺激;造成严重的眼睛刺激;可能导致嗜睡或头晕;可能导致器官损伤 |
| AN 标识符 | 联合国2452 |
| 海关编码 | 2903.49.90 |
| 危险等级 | 2.1 |
| 包装组别 | 二 |
| 毒性 | 毒性低,但高浓度吸入可能会对健康造成影响。 |
氟甲烷合成方法
有几种方法,包括直接甲烷氟化和卤素交换反应,可以合成氟代甲烷。
常见的方法是甲醇与氟化氢在催化剂(例如氧化铝或氟化铝)存在下反应。
另一种方法涉及氯甲烷或溴甲烷与氟化氢气体的反应。这两种方法都会产生副产物氟代甲烷,然后可以通过蒸馏或其他方法将其分离和纯化。
另一种合成氟代甲烷的方法涉及三氟甲烷和氯化氢在催化剂(例如锌或铜)存在下的反应。该反应产生氯氟甲烷和氟甲烷的混合物,可以通过蒸馏将其分离和纯化。
氟甲烷的用途
氟甲烷在各个行业中有多种用途,包括:
- 制冷:由于其沸点低且不易燃,在工业和商业制冷系统中用作制冷剂。
- 电子:用作电子元件的清洗剂和半导体工业中的等离子蚀刻剂。
- 医疗应用:因其毒性低、作用迅速,在兽医学中用作麻醉剂。
- 农药生产:用作生产某些农药(包括除草剂和杀虫剂)的前体。
- 聚合物生产:在聚合物泡沫生产中用作发泡剂,例如聚氨酯泡沫。
- 实验室应用:在各种实验室应用中用作溶剂和试剂,包括化学合成和分析。
- 灭火:也用作某些类型的灭火器的灭火剂,特别是计算机房和电信机房中使用的灭火器。
问题:
问:CH3F是极性的还是非极性的?
答:CH3F 是一种极性分子,因为氟原子和氢原子围绕中心碳原子不对称排列,从而产生净偶极矩。
问:CH3F有氢键吗?
答:氟代甲烷不具有氢键,因为它不包含与氮、氧或氟等高电负性元素键合的氢原子。
问:哪种化合物的分子间作用力最强:HF、CH3Cl、CH3F、HCl?
答:HF 由于能够形成氢键,因此具有最强的分子间力,比其他化合物的偶极-偶极力更强。
问:N2、CO、CH3F、HCl 哪个偶极-偶极力最弱?
答:N2 具有最低的偶极-偶极力,因为它是非极性分子,因此没有净偶极矩。 CO、CH3F 和 HCl 是极性分子,具有偶极-偶极力,但由于分子极性增加,这些力的强度按 HCl < CH3F < CO 的顺序增加。
