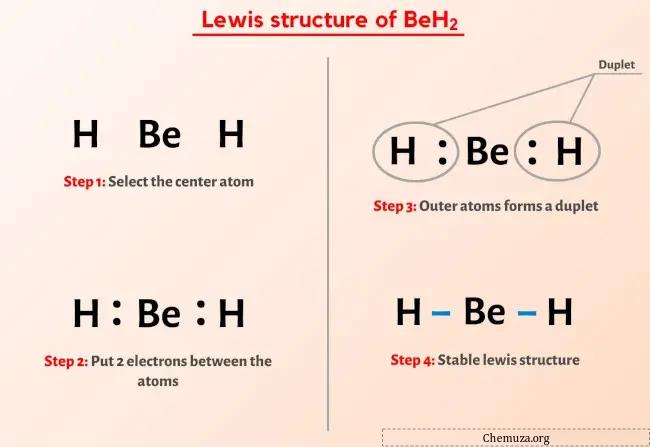
所以你已经看过上面的图片了,对吧?
让我简单解释一下上图。
BeH2 路易斯结构的中心有一个铍 (Be) 原子,周围有两个氢 (H) 原子。铍 (Be) 原子和每个氢 (H) 原子之间有 2 个单键。
如果您对上面的 BeH2(氢化铍)路易斯结构图像没有理解任何内容,那么请继续关注我,您将获得有关如何绘制BeH2路易斯结构的详细逐步说明。
那么让我们继续绘制 BeH2 的路易斯结构的步骤。
绘制 BeH2 路易斯结构的步骤
步骤 1:找出 BeH2 分子中的价电子总数
为了找到 BeH2(氢化铍)分子中的价电子总数,您首先需要知道铍原子和氢原子中存在的价电子。
(价电子是存在于任何原子最外层轨道的电子。)
在这里我将告诉您如何使用元素周期表轻松找到铍和氢的价电子。
BeH2 分子中的总价电子
→ 铍原子给出的价电子:
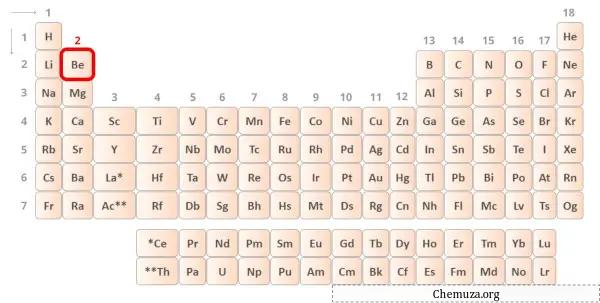
铍是元素周期表中的第 2 族元素。 [1]因此,铍中存在的价电子为2 。
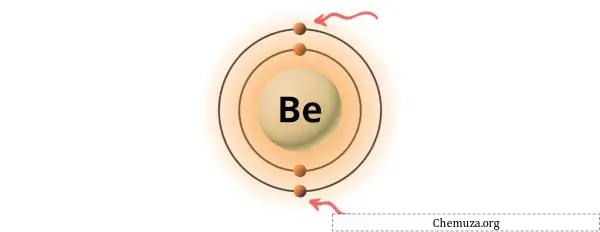
您可以看到铍原子中存在 2 个价电子,如上图所示。
→ 氢原子给出的价电子:
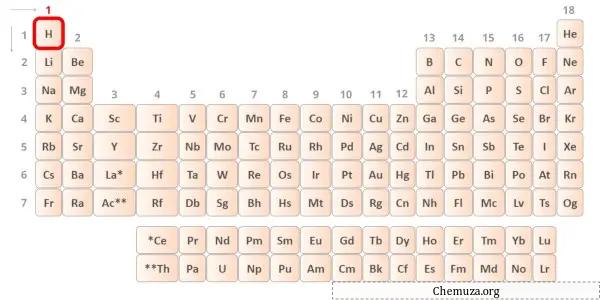
氢是元素周期表中的第 1 族元素。[2]因此,氢中存在的价电子为1 。

您可以看到氢原子中只存在一个价电子,如上图所示。
所以,
BeH2 分子中的总价电子= 1 个铍原子贡献的价电子 + 2 个氢原子贡献的价电子 = 2 + 1(2) = 4 。
第二步:选择中心原子
为了选择中心原子,我们必须记住电负性最小的原子保留在中心。
(记住:如果给定分子中存在氢,则始终将氢放在外面。)
现在这里给定的分子是BeH2(氢化铍),它包含铍原子(Be)和氢原子(H)。
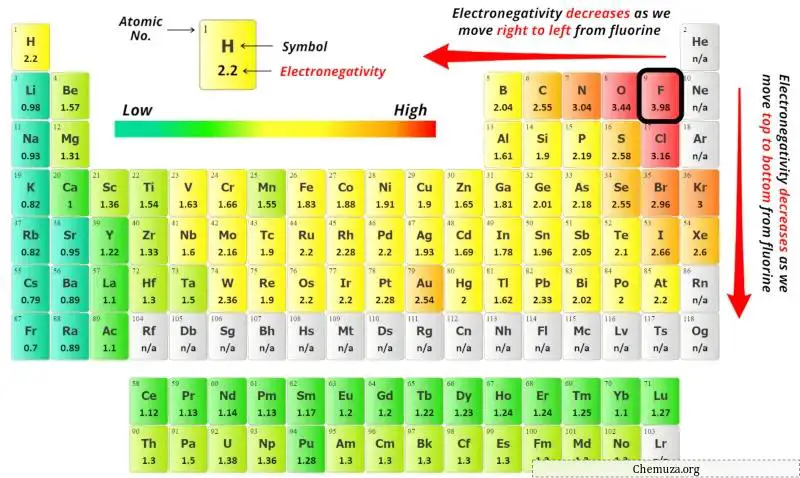
您可以在上面的元素周期表中看到铍原子(Be)和氢原子(H)的电负性值。
如果我们比较铍(Be)和氢(H)的电负性值,那么氢原子的电负性较小。但根据规则我们必须将氢气保留在外面。
这里,铍 (Be) 原子是中心原子,氢 (H) 原子是外部原子。

第三步:通过在原子之间放置一对电子来连接每个原子
现在,在 BeH2 分子中,我们必须将电子对置于铍原子 (Be) 和氢原子 (H) 之间。

这表明铍 (Be) 和氢 (H) 在 BeH2 分子中彼此化学键合。
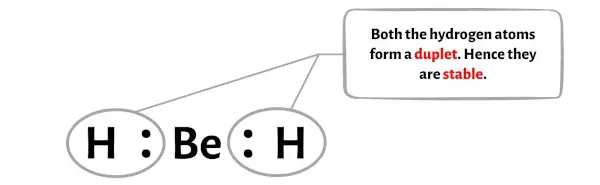
第四步:使外部原子稳定
在此步骤中,您需要检查外部原子的稳定性。
在 BeH2 分子的示意图中,您可以看到外部原子是氢原子。
这些外部氢原子形成二重态,因此是稳定的。
此外,在步骤 1 中,我们计算了 BeH2 分子中存在的价电子总数。
BeH2 分子共有4 个价电子,所有这些价电子都用于上面的 BeH2 图中。
因此,中心原子上不再有电子对。
现在让我们继续下一步。
第五步:检查中心原子的稳定性
在此步骤中,您需要检查中心铍 (Be) 原子是否稳定。
现在,铍只需要 4 个电子就能变得稳定。铍的 s 轨道完全被这 4 个电子充满。
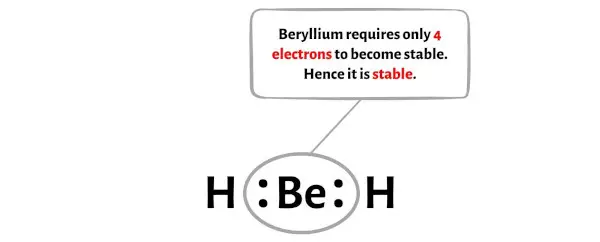
您可以在上图中看到铍原子有 4 个电子,因此是稳定的。
现在让我们进行最后一步,检查 BeH2 的路易斯结构是否稳定。
第6步:检查路易斯结构的稳定性
现在您已完成最后一步,您需要检查 BeH2 路易斯结构的稳定性。
路易斯结构的稳定性可以使用形式电荷概念来验证。
简而言之,我们现在需要找到铍原子 (Be) 以及 BeH2 分子中氢原子 (H) 的形式电荷。
要计算正式税,您必须使用以下公式:
形式电荷 = 价电子 – (键合电子)/2 – 非键合电子
您可以在下图中看到 BeH2 分子每个原子的键合电子和非键合电子数量。
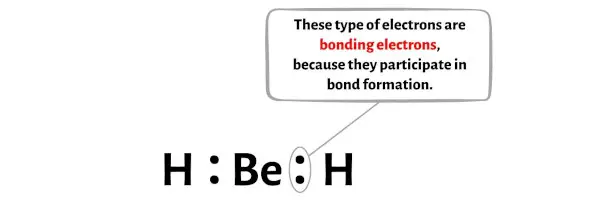
对于铍原子 (Be):
价电子 = 2(因为铍属于第 2 族)
键合电子 = 4
非键合电子 = 0
对于氢原子 (H):
价电子 = 1(因为氢属于第 1 族)
键合电子 = 2
非键合电子 = 0
| 正式指控 | = | 价电子 | – | (结合电子)/2 | – | 非键合电子 | ||
| 是 | = | 2 | – | 4/2 | – | 0 | = | 0 |
| H | = | 1 | – | 2/2 | – | 0 | = | 0 |
从上面的形式电荷计算中,您可以看到铍 (Be) 原子和氢 (H) 原子具有“零”形式电荷。
这表明BeH2的上述Lewis结构是稳定的,BeH2的上述结构没有发生进一步的变化。
在上述 BeH2 的路易斯点结构中,您还可以将每对成键电子 (:) 表示为单键 (|)。这样做将产生以下 BeH2 的路易斯结构。

我希望您已经完全理解上述所有步骤。
为了进行更多练习和更好地理解,您可以尝试下面列出的其他路易斯结构。
尝试(或至少查看)这些路易斯结构以更好地理解:
