氯酸钾(KClO3)是一种由钾、氯和氧组成的化合物。由于其氧化特性,它通常用于制造火柴、炸药和烟花。
| 国际纯粹和应用化学联合会名称 | 氯化钾 |
| 分子式 | 氯化钾 |
| CAS 号 | 3811-04-9 |
| 同义词 | 氯酸钾,Chlorkalic,氯酸钾,高氯酸钾,UN 1485,氯酸钾,高氯酸钾 |
| 乙酰胆碱 | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
氯酸钾性质
氯酸钾配方
氯酸钾的化学式为KClO3,表明它由1个钾原子、1个氯原子和3个氧原子组成。它是一种离子化合物,当 K+ 和 ClO3- 离子通过离子键结合时形成。由于氧的存在,该化合物非常活泼,具有很强的氧化特性。
氯酸钾 摩尔质量
KClO3 的摩尔质量为 122.55 g/mol。它是构成化合物的各个元素(即钾、氯和氧)的原子质量之和。摩尔质量是化学中的一个重要参数,因为它用于计算在化学反应中产生一定量产物所需的物质的质量。
氯酸钾的沸点
KClO3 没有明确的沸点,因为它在达到沸点之前就分解了。加热时分解成氯化钾和氧气。因此,KClO3 发生热分解反应而不是沸点。
氯酸钾熔点
KClO3 的熔点为 356°C (673°F)。在此温度下,固体化合物熔化并变成液体。熔点是化合物的基本属性,因为它影响物质的物理行为,包括其溶解度和密度。
氯酸钾密度 g/mL
室温下 KClO3 的密度为 2.32 g/mL。这意味着特定体积的化合物具有一定的质量,这对于确定特定化学反应所需的物质的质量很有用。 KClO3 的密度也会影响其在水中的溶解度,因为密度较高的化合物往往不易溶于水。
氯酸钾分子量
KClO3的分子量为122.55 g/mol。它是其组成原子(即钾、氯和氧)的原子量之和。分子量是化学计量中的一个重要参数,因为它用于计算化学反应中反应物和产物的数量。
氯酸钾的结构
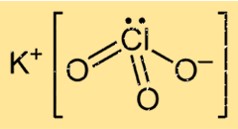
KClO3 具有固体形式的晶体结构,由以特定模式排列的钾、氯和氧原子组成。该化合物形成面心立方晶格结构,其中每个钾离子被六个氧原子包围,每个氧离子被四个钾原子和两个氯原子包围。
氯酸钾的溶解度
KClO3在水中具有中等溶解度,室温下溶解度为7克/100毫升水。化合物的溶解度随着温度的升高而增加,因为水分子具有更多的动能并且可以溶解更多的化合物。 KClO3也溶于其他极性溶剂,如乙醇和丙酮。
| 外貌 | 白色结晶固体 |
| 比重 | 2.32克/立方厘米 |
| 颜色 | 白色的 |
| 闻 | 无味 |
| 摩尔质量 | 122.55 克/摩尔 |
| 密度 | 2.32克/立方厘米 |
| 融合点 | 356°C (673°F) |
| 沸点 | 沸腾前分解 |
| 闪点 | 不适用 |
| 水中溶解度 | 7 克/100 毫升,20°C |
| 溶解度 | 溶于乙醇和丙酮 |
| 蒸汽压力 | 不适用 |
| 蒸气密度 | 不适用 |
| 酸度 | 1.8(Ka=1.6×10⁻⁵) |
| 酸碱度 | 0.1 M 溶液的 pH 值约为 6.5 至 7.5 |
氯酸钾的安全性和危险性
KClO3 是一种高反应性且具有潜在危险的物质,因此应极其小心地处理。它会引起严重的皮肤和眼睛刺激,吞咽或吸入可能有毒。受热时会发生剧烈反应,甚至爆炸。 KClO3 还可以与其他化学品(例如硫酸和有机化合物)发生强烈反应,并产生有毒气体(例如氯气和二氧化氯酸盐)。使用 KClO3 时,务必遵循正确的安全规程,包括佩戴防护设备并在通风良好的区域工作。
| 危险符号 | O、Xi、N |
| 安全说明 | 避免接触可燃材料。吞咽有毒。造成严重皮肤烧伤和眼睛损伤。 |
| 联合国识别号 | 联合国1485 |
| 海关编码 | 2829.90.10 |
| 危险等级 | 5.1 |
| 包装组别 | 二 |
| 毒性 | 剧毒 |
氯酸钾的合成方法
KClO3 的合成方法有多种。
一种方法涉及氯化钾和漂白剂之间的反应。该方法包括将漂白剂溶液添加到氯化钾溶液中并搅拌混合物。过滤并洗涤获得的沉淀物,得到KClO3。
另一种方法涉及电解含有氯化钾、水和氧源的溶液。电解池是一种专用设备,通过分离钾离子和氯离子并产生氧气来执行此过程。氧气与钾离子反应生成 KClO3。
第三种方法涉及氢氧化钾和氯气之间的反应,生成 KClO3、氯化钾和水。该方法需要仔细控制试剂的温度和浓度以确保最佳产量。
氯酸钾的用途
KClO3 在各个行业有着广泛的用途,包括:
- 烟火产品:通常用作烟花和其他烟火装置中的氧化剂。
- 火柴:用于安全火柴头,当撞击粗糙表面时会点燃。
- 肥料:用作植物肥料的钾源。
- 漂白剂:用作纺织品、纸张和其他材料的漂白剂。
- 实验室试剂:也用作各种化学反应的实验室试剂。
- 医疗应用:用于治疗某些类型的皮肤病,例如湿疹。
- 炸药:某些类型炸药的常见成分,例如雷管和炸药。
- 氧化剂:在某些化学品(例如高氯酸盐)的生产中用作氧化剂。
问题:
问:25克氯酸钾分解产生多少克氯化钾?
答:25克KClO3分解时,产生13.47克氯化钾。
问:如何制取氯酸钾?
答:KClO3 可以通过氯化钾与漂白剂反应、电解含氯化钾的溶液或氢氧化钾与氯气反应来制备。
问:2 摩尔氯酸钾 (kclo3) 分解时会产生多少摩尔氧气?
答:2摩尔KClO3分解时,会产生3摩尔氧气。
问:0.70 m 的溶液含有 3.0 g 氯酸钾 (kclo3)。溶液的体积是多少?
答:含有 3.0 g KClO3 的 0.70 m 溶液的体积为 51.4 mL。
问:氯酸钾易挥发吗?
答:KClO3 不被视为挥发性物质,因为它具有相对较高的熔点和沸点。
问:如果分解 2.50 克 kclo3,会产生多少 kcl?
答:2.50克KClO3分解时,会产生1.35克氯化钾。
问:kclo3 溶于水吗?
答:是的,KClO3 极易溶于水,室温下溶解度为 7 g/100 mL。
问:100克氯分解能产生多少克氧气?
答:100克KClO3分解时,产生45.02克氧气。
