肼或 N2H4 是一种由氮和氢组成的无色、高活性化合物。它被用作火箭推进剂、药物和农用化学品以及化学反应中的还原剂。
| 国际纯粹和应用化学联合会名称 | 联氨 |
| 分子式 | N2H4 |
| CAS 号 | 302-01-2 |
| 同义词 | 二胺;二氮烷;氮氢化物;无水肼;无水肼;氢氧化肼;水合肼;甲基肼;对称肼 |
| 乙酰胆碱 | InChI=1S/H4N2/c1-2/h2H,1H2 |
路易斯结构N2H4:
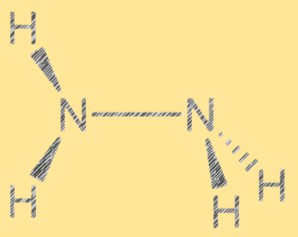
肼的路易斯结构显示了分子中电子的排列。该结构由两个氮原子和四个氢原子组成,每个氮原子都有一对自由电子。两个氮原子通过单个共价键连接,每个氮原子还与两个氢原子连接。肼的路易斯结构有助于解释其反应性和性质。
化合物N2H4名称:
化合物N2H4的名称是肼。该名称来源于肼是一种含有氢和氮原子的化合物。肼还有各种其他名称,包括二胺、二氮烷和氮氢化物。
摩尔质量 N2H4:
肼的摩尔质量为32.04 g/mol,分子式为N2H4。它是一种相对较轻的化合物,由两个氮原子和四个氢原子组成。肼的低摩尔质量是其通常用作火箭燃料的原因之一,因为它提供了高推重比。
肼的沸点:
肼在大气压下的沸点为 113.5 °C (236.3 °F)。这种低沸点意味着肼很容易蒸发,这使得处理起来很危险。加热时,联氨会分解成氮气和氢气,这也使其变得危险。
肼的熔点:
肼的熔点为-51.7 °C (-61.06 °F)。这意味着肼在室温和压力下是液体。它的低熔点也意味着它很容易在较冷的温度下凝固,这使得它难以处理。
肼的密度g/ml:
室温常压下肼的密度为1.00 g/mL。这意味着肼的密度比水稍大,在相同条件下,水的密度为 1.00 g/mL。
肼的分子量:
肼的分子量为32.04 g/mol。该值用于计算化学反应和其他应用中所需的肼的量。
肼的结构:
肼的结构由通过单个共价键连接在一起的两个氮原子组成,每个氮原子还与两个氢原子连接。这使得肼具有对称的V形分子结构。肼的结构对其反应活性和性质起着重要作用。
联氨分子式:
肼的化学式是N2H4。该式表明肼由两个氮原子和四个氢原子组成。该式用于表示化学方程式和反应中的肼。
| 外貌 | 无色至淡黄色液体 |
| 比重 | 1.00克/毫升 |
| 颜色 | 无色 |
| 闻 | 氨味 |
| 摩尔质量 | 32.04 克/摩尔 |
| 密度 | 1.00克/毫升 |
| 融合点 | -51.7°C (-61.06°F) |
| 沸点 | 113.5°C (236.3°F) |
| 闪点 | 38°C(100°F) |
| 水中溶解度 | 混溶 |
| 溶解度 | 溶于乙醇、乙醚、氯仿 |
| 蒸汽压力 | 20°C 时为 72 毫米汞柱 |
| 蒸气密度 | 1.0(空气=1) |
| 酸度 | 8 |
| 酸碱度 | 碱性(pH > 7) |
肼的安全和危险
肼是一种高活性且危险的化合物,需要小心处理和储存。它有毒,接触皮肤、眼睛或粘膜会导致严重烧伤。吸入肼蒸气还会引起呼吸道刺激、肺部损伤,在极端情况下甚至会致命。肼也是易燃的,很容易点燃,特别是在与某些材料(例如氧化剂)接触时。由于这些危险,在处理联氨时应采取适当的安全预防措施和个人防护设备,并且只能由接受过适当安全培训的合格专业人员在通风良好的区域使用。
| 危险符号 | 骷髅和交叉骨,火焰 |
| 安全说明 | 仅在通风良好的区域使用。戴上手套、衣服和眼睛/面部防护装置。避免与皮肤,眼睛和衣服接触。远离热源、火花和火焰。 |
| 联合国识别号 | 联合国2030 |
| 海关编码 | 282510 |
| 危险等级 | 6.1(有毒物质) |
| 包装组别 | 二 |
| 毒性 | 摄入、吸入和皮肤接触毒性很大。可能导致严重烧伤和组织损伤。长期接触会导致肝肾损伤,并可能潜在致癌。 |
肼的合成方法
肼可以通过多种方法合成,具体取决于所需的纯度和具体应用。合成肼的一些常见方法是:
- 拉西法:该方法涉及氨和次氯酸钠在铜或镍等催化剂存在下的反应。
- 奥林-拉西法:该过程涉及尿素和盐酸反应生成水合肼。
- 酮连氮工艺:该工艺涉及丙酮与氨在雷尼镍等催化剂存在下发生反应。
- 过氧化物工艺:该工艺涉及过氧化氢和氨在铂或钯等催化剂存在下的反应。
- 拜耳法:该过程涉及次氯酸钠与尿素在铜或镍等催化剂存在下发生反应。
- Houben-Hoesch 反应:该反应涉及亚硝酸与氨在锌等还原剂存在下的反应。
每种方法都有其自身的优点和缺点,方法的选择将取决于成本、收率、纯度和安全性考虑等因素。肼合成应谨慎进行,因为肼是一种危险物质,如果处理不当,可能对人体健康和安全构成风险。
肼的用途
N2H4由于其独特的化学性质,在工业、商业和军事方面有着广泛的应用。 N2H4 的一些常见用途包括:
- 由于 N2H4 能量含量高且稳定性好,许多公司使用 N2H4 作为火箭燃料。
- N2H4 在某些聚合物(包括尼龙和凯夫拉纤维)的生产中用作聚合剂。
- 化学家在化学合成反应中使用 N2H4 作为还原剂,特别是在药物、农药和其他有机化合物的生产中。
- N2H4 在金属电镀过程中充当还原剂,特别是镀镍过程中。
- 水处理厂使用 N2H4 作为除氧剂,特别是在锅炉和冷却塔中。
- 摄影师使用 N2H4 作为摄影显影剂,特别是在黑白摄影中。
- 汽车制造商依靠 N2H4 作为汽车安全气囊系统中的充气机。
- 工业中使用 N2H4 作为某些设备和表面的清洁剂,特别是在电子工业中。
尽管肼有许多有用的用途,但它也是一种危险物质,应小心处理。处理肼时应采取适当的安全预防措施和个人防护设备,并且只能由接受过适当安全培训的合格专业人员使用。
问题:
N2H4 中 N 的氧化数(氧化态)是多少?
在N2H4中,N的氧化数(氧化态)为-2。每个氢原子的氧化数为+1,并且由于N2H4是中性分子,因此所有原子的氧化数之和必须等于0。由于N2H4中有两个氮原子,因此分子中氮的总氧化数为-4。因此,每个氮原子的氧化数为-2,这平衡了氢原子的氧化数。
N2H4 的化合物叫什么名字?
化合物 N2H4 通常称为肼。
肼 (n2h4) 与过氧化氢 (h2o2) 以及肼与水的摩尔比是多少?
肼 (N2H4) 与过氧化氢 (H2O2) 以及肼与水的摩尔比可以根据各个反应的平衡化学方程式确定。
当肼与过氧化氢反应时,根据以下平衡方程产生氮气(N2)、水(H2O)和氧气(O2):
N2H4 + H2O2 → N2 + 2H2O + O2
根据该方程式,肼与过氧化氢的摩尔比为1:1。这意味着反应中每使用一摩尔肼,就会消耗一摩尔过氧化氢。
肼与水反应生成水合肼,化学式为N2H4·H2O。该反应的平衡化学方程式为:
N2H4 + H2O → N2H4·H2O
根据该方程式,肼/水摩尔比为1:1。这意味着反应中每使用一摩尔肼,就会消耗一摩尔水并产生一摩尔水合肼。
