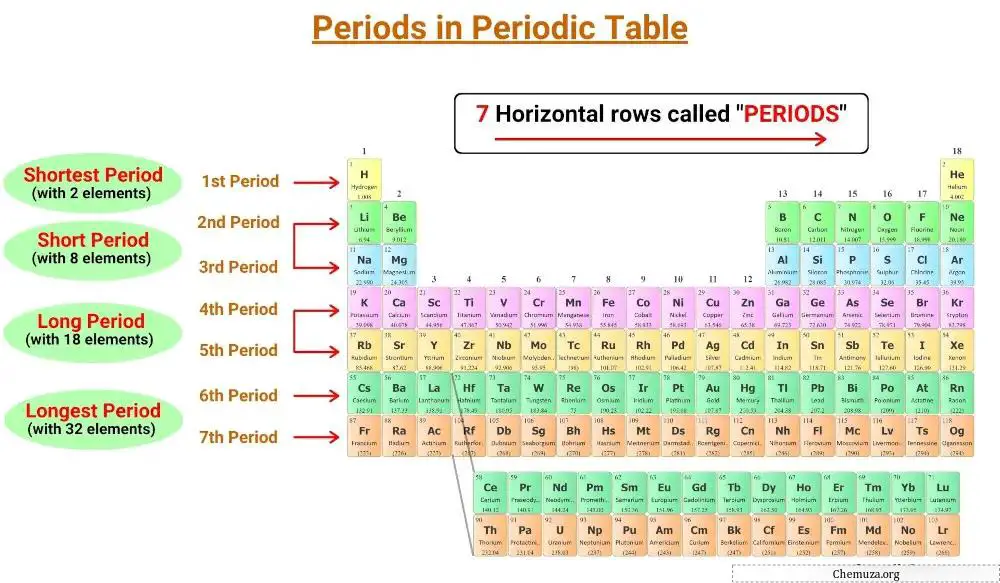
元素周期表的水平线称为周期,周期表中有7个周期。
位于同一时期的元素具有相同数量的电子层。
让我们进一步探讨元素周期表上的周期。
元素周期表中的周期是什么?
在元素周期表中,点是从左向右水平延伸的线。
元素周期表的组织方式是将具有相似性质的元素分为称为组或族的列,而来自同一周期的元素具有相同数量的电子层。
元素周期表中有七个周期,编号为 1 至 7。 [1]
元素的壳数及其周期数
元素的壳层数决定了它在元素周期表中的周期。
例如,第1周期元素只有一个电子壳层,而第2周期元素有两个电子壳层,依此类推。
该组织帮助化学家根据元素在周期表中的位置来预测元素的属性。
各时期元素的特征
当您浏览元素周期表的某个时期时,元素的一些特性会以可预测的方式发生变化。这是由于在元素属性中观察到的周期性趋势。
原子半径:
当你从左向右移动一段时间时,原子半径通常会减小。 [2]
这是因为原子核中的质子数量增加,导致原子核和最外层能级的电子之间的吸引力更大。这导致更小的原子半径。
电负性:
电负性是原子在化学键中吸引电子向自身的能力的量度。
当您从左向右移动一段时间时,电负性通常会增加。 [3]
这是因为原子半径较小,原子核的正电荷较强,对带负电的电子更具吸引力。
电离能:
电离能是从原子中除去电子所需的能量。
当您从左向右移动一段时间时,电离能通常会增加。 [4]
这是因为原子半径较小,电子被原子核束缚得更紧,因此更难以去除电子。
其他特性:
熔点和沸点:通常在一段时间内从左到右增加,但也有一些例外。
金属特性:随着非金属变得更加普遍,在一段时间内从左到右逐渐减弱。
反应性:当您在一段时间内从左向右移动时,元素的反应性会降低,因为电子被束缚得更紧并且不太可能参与化学反应。
化学中周期的重要性
元素周期表的周期对于理解元素的行为至关重要,因为它们提供了有关元素的电子配置以及它们如何与其他元素相互作用的信息。以下是周期在化学中很重要的一些原因:
- 预测属性:元素周期表允许科学家根据元素在表中的位置来预测元素的属性。例如,同一时期的元素具有相同数量的电子壳层,这可以帮助预测它们的原子大小、反应性和其他属性。
- 识别趋势:元素周期表中元素的排列使科学家能够识别其特性的趋势。例如,电负性和电离能在一段时间内从左到右趋于增加,而原子尺寸趋于减小。该信息可用于预测元素在化学反应中的行为。
- 元素分组:元素周期表根据元素的属性将元素分为几类,例如金属、非金属和准金属。这有助于科学家了解元素之间的异同以及它们如何相互作用。
- 发现新元素:元素周期表还可以帮助科学家预测新元素的存在和性质。通过检查表中的空白,科学家可以预测未发现元素的特性并在实验室中研究它们。
概括
元素周期表有七条水平线,称为周期。同一时期的元素具有相同数量的电子层。元素周期表中有七个周期,编号为1到7,元素的壳层数决定了它的周期。
当你经历元素周期表的一个周期时,原子半径通常会减小,而电负性和电离能通常会增加。其他特性,如熔点和沸点、金属特性和反应性,也会随着时间的推移而发生可预测的变化。
元素周期表的周期对于预测元素的性质、识别趋势、对元素进行分组和发现新元素非常重要。通过检查表中的空白,科学家可以预测未发现元素的特性并在实验室中研究它们。
