元素根据共同特征进行分组,包括电子配置和价电子的行为。
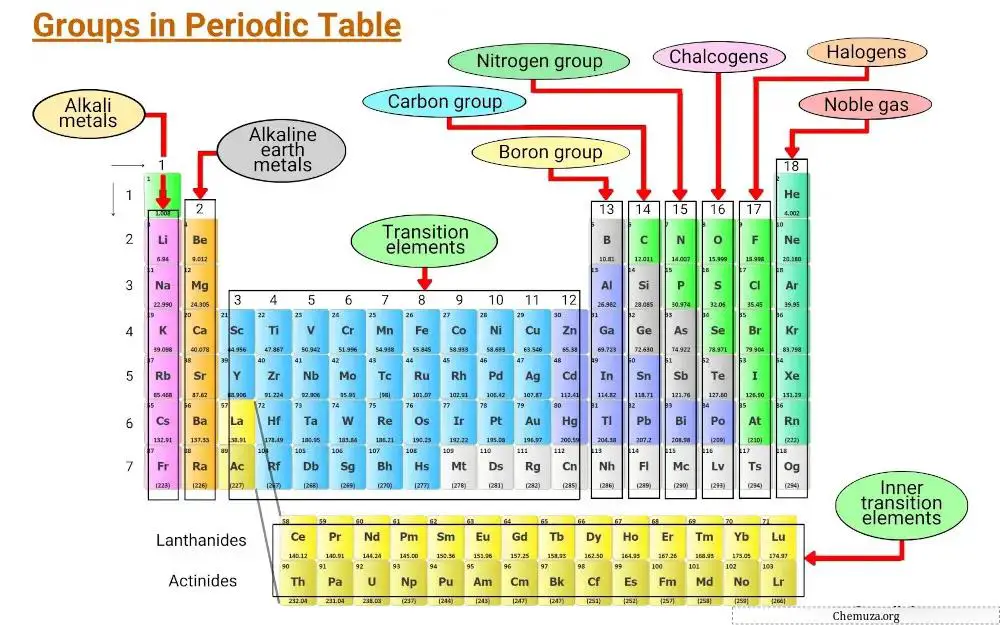
元素周期表的垂直列称为族,元素周期表中有 18 个族,每个族都有自己的一组属性,这些属性决定元素如何与其他元素相互作用并形成化合物。
在本文中,我们将探讨元素周期表上的不同族。
让我们直接开始吧!
第一组:碱金属
该组包括锂、钠、钾、铷、铯和钫。
碱金属以其柔软、熔点低以及与水和空气的高反应性而闻名。
碱金属的反应性很强,因为它们的最外层只有一个电子,很容易释放电子形成正离子。 [1]
这使得它们成为优异的电导体,可用于许多应用,包括电池和工业过程。
然而,由于碱金属的高反应性,必须小心处理。它们可以在空气中自燃并与水发生爆炸反应,释放出氢气。 [2]
第 2 组:碱土金属
元素周期表第 2 族被称为“碱土金属”。该族包括六种元素:铍、镁、钙、锶、钡和镭。
这些金属被称为“碱性”,因为它们与水反应形成碱性(碱性)溶液。
碱土金属具有类似的特性,包括高熔点和沸点、低密度以及能够轻松形成带+2电荷的离子。
它们也很容易发生反应,尤其是与水和氧气反应。然而,与第 1 族碱金属不同,它们的反应性较低且熔点较高。
这些元素存在于许多日常物品中,包括骨头(钙)、烟花(锶)和飞机零件(镁)。
碱土金属也用于工业过程,例如铝和钢的生产。
第 3 – 11 组:过渡金属
元素周期表中的第3族至第11族被称为过渡金属族。这些金属具有独特的特性,使它们与桌子上的其他物品区分开来。
过渡金属的定义特征之一是它们形成有色化合物的能力。
这是由于它们独特的电子配置,使它们能够吸收和反射某些波长的光。 [3]
过渡金属还以其高熔点和沸点以及强度和耐用性而闻名。
它们经常用于建筑材料、电线甚至珠宝。
第13族:硼族
元素周期表中的第 13 族被称为硼族,包括元素硼 (B)、铝 (Al)、镓 (Ga)、铟 (In)、铊 (Tl) 和镍 (Nh)。
这些元素具有某些共同的特征,使它们在化学上相似。
硼是该族中唯一的准金属,这意味着它同时具有金属和非金属特性。
第14组:碳组
元素周期表中的第 14 族被称为碳族,包括碳 (C)、硅 (Si)、锗 (Ge)、锡 (Sn)、铅 (Pb) 和铍 (Fl)。
这些元素具有相似的性质,因为它们都有四个价电子。
碳是一种非常重要的元素,因为它构成了所有有机分子的基础,包括蛋白质和 DNA 等生命的组成部分。 [4]
第 15 组:产烟剂
元素周期表第 15 族也称为氮族(或氮元素)。
该族包含 6 种元素:氮 (N)、磷 (P)、砷 (As)、锑 (Sb)、铋 (Bi) 和莫斯科 (Mc)。
第 15 族元素的最外层电子层有 5 个价电子,这意味着它们倾向于形成三个共价键来完成其八位组。
它们还倾向于获得三个电子以形成阴离子。该族元素的非金属性越来越低,金属性越来越强。
第 16 组:硫属元素
元素周期表中的第 16 族被称为氧基。它包括元素氧 (O)、硫 (S)、硒 (Se)、碲 (Te)、钋 (Po) 和肝 (Lv)。
这些元素具有某些共同特征,包括在最外层能级具有六个价电子。
氧是该族中最丰富的元素,对生命至关重要,因为它是水和许多有机分子的关键组成部分。
氧基中的元素可以与许多其他元素形成化合物,包括金属和非金属。
第 17 组:卤素
元素周期表第 17 族也称为卤素族。它由六种元素组成:氟、氯、溴、碘、砹和丁烯。
所有卤素的最外层都有七个电子,也称为价层。这使得它们非常活跃,因为它们只需要一个额外的电子来完成它们的外壳并变得稳定。
卤素的另一个重要特征是它们都是非金属,这意味着它们不导电,并且不像金属那样具有延展性或延展性。
它们在室温下也以所有三种物质状态存在,其中氟和氯是气体,溴是液体,碘和砹是固体。
第 18 组:稀有气体
稀有气体包括氦 (He)、氖 (Ne)、氩 (Ar)、氪 (Kr)、氙 (Xe) 和氡 (Rn)。
这些气体被称为惰性气体,因为它们非常稳定,不易与其他元素发生反应。
稀有气体位于元素周期表的最右一列,它们都具有完整的电子外壳,这使得它们非常不活泼。
它们也无味、无色且沸点和熔点较低。
