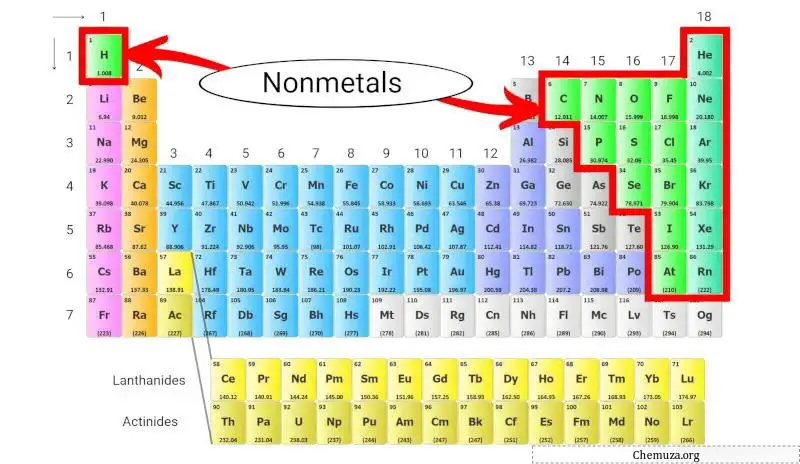
非金属是一组缺乏金属特性的元素,例如高导电性和光泽。除氢外,这些非金属均位于元素周期表的右侧。
非金属有多种形式,包括氧气和氯气等气体、溴等液体以及硫和碳等固体。 [1]
让我们看看有关非金属的更重要的事情。
非金属到底是什么?
非金属是在化学反应中倾向于获得电子、形成带负电的离子或阴离子的元素。
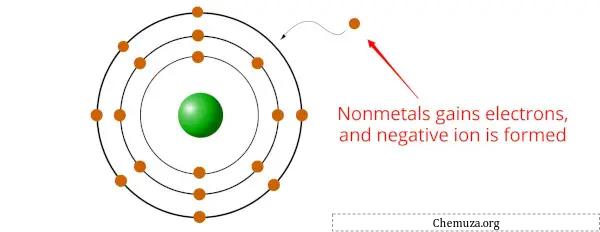
这是因为非金属通常比金属具有更高的电负性, [2] 这意味着它们对电子具有更大的吸引力。
当非金属与金属结合时,非金属元素从金属中获得一个或多个电子,形成稳定的化合物。
例如,氯从钠中获得电子,形成离子化合物氯化钠 (NaCl)。
也可以说——非金属是一组不具有金属物理和化学性质的化学元素。
好吧,让我们看看元素周期表中存在的非金属列表。
元素周期表中存在的非金属列表
以下是元素周期表中存在的非金属列表:
- 氢 (H)
- 氦气 (He)
- 碳(C)
- 氮 (N)
- 氧气 (O)
- 萤石 (F)
- 霓虹灯(氖)
- 磷(P)
- 硫(S)
- 氯 (Cl)
- 氩气 (Ar)
- 硒 (Se)
- 溴 (Br)
- 氪 (Kr)
- 碘 (I)
- 氙 (Xe)
- 砹(At)
- 氡 (Rn)
这些非金属位于元素周期表的右侧,但氢除外,氢位于元素周期表的顶部,高于碱金属。
非金属状态(固态、液态还是气态?)
非金属可以以所有三种物质状态存在:固体、液体和气体。
非金属的状态取决于其所暴露的温度和压力条件。
元素周期表中所有非金属中;
- 11种非金属在室温下呈气态。 [3]
- 溴 (Br) 是一种非金属,在室温下呈液态。
- 其余非金属在室温下为固体。
最活泼的非金属
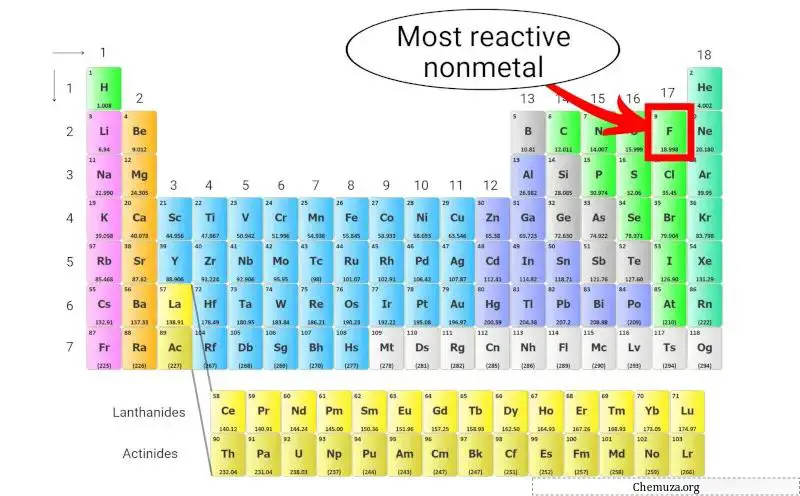
氟(F) 是元素周期表中最具反应性的非金属。
但为什么?为什么氟化物最活泼?
这是因为它具有所有元素中最高的电负性,这意味着它对电子具有很强的吸引力。
氟的最外层能级有七个电子,需要一个额外的电子来填充其价电子层并达到稳定的构型。
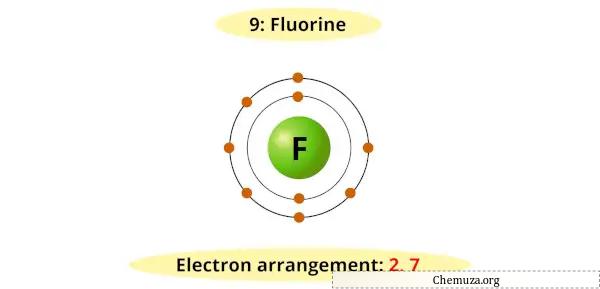
因此,它很容易接受来自其他元素的电子,形成氟离子(F-)。
由于其高反应性,氟可以与许多其他元素和化合物发生爆炸性反应,包括水、金属,甚至玻璃。 [4]
氟的反应性很强,因此通常在由耐腐蚀性材料制成的专用容器中储存和运输。
非金属在环境和工业应用中的作用
非金属由于其独特的性质而被用于各种工业过程和环境应用。这里有些例子:
- 空气污染控制:氮气和氧气等非金属在控制空气污染方面发挥着至关重要的作用。氮氧化物 (NOx) 是车辆和工业过程中释放的有害污染物。非金属催化剂用于将氮氧化物转化为氮气和水等无害气体。同样,在燃烧过程中使用氧气来减少有害排放。
- 肥料:氮、磷、硫是植物生长必需的营养物质。硝酸铵和过磷酸钙等非金属肥料广泛用于农业以提高农作物产量。
- 电池:电池中使用硫、碳、锂等非金属元素。锂离子电池通常用于电子设备、电动汽车和可再生能源系统。
- 水净化:氯和碘等非金属通常用作水净化系统中的消毒剂。它们可以杀死有害细菌和病毒,使水可以安全饮用。 [5]
- 化学品制造:硫、氯等非金属广泛用于硫酸、盐酸、氯基溶剂等化学品的生产。
概括
非金属缺乏金属的高导电性和光泽等特性,位于元素周期表的右侧,但氢除外。根据温度和压力条件,它们以所有三种物质状态存在。
氟由于其高电负性而成为最具反应性的非金属,并且很容易接受其他元素的电子形成氟离子(F-)。
非金属在环境和工业应用中具有多种用途,包括空气污染控制、肥料、电池、水净化和化学品制造。
