什么是NH4+铵?
铵离子 (NH4+) 是一种带正电的多原子离子,由一个氮原子和四个氢原子组成。它常见于肥料和有机化合物中。
| 国际纯粹和应用化学联合会名称 | 阿扎尼姆 |
| 分子式 | 氨水+ |
| CAS 号 | 14798-03-9 |
| 同义词 | 铵阳离子、四氢氮 (1+)、铵、氮鎓、氮氢化物阳离子、氢氮、氮离子 |
| 乙酰胆碱 | InChI=1S/H3N/h1H3/p+1 |
注:InChI 涉及最简单形式的铵离子,具有单个电离氢。实际的 InChI 可能会根据铵离子的化学环境而变化。
铵式
铵离子的化学式是NH4+。它是由一个氮原子和四个氢原子组成的多原子阳离子。氨 (NH3) 与氢离子 (H+) 质子化形成铵离子。铵离子是无机和有机化合物(包括化肥、药品和炸药)中的常见阳离子。
铵阳离子
铵阳离子,也称为NH4+,是一种带正电的多原子离子,由一个氮原子和四个氢原子组成。当氨 (NH3) 接受酸中的质子 (H+) 时形成铵盐。
铵离子的摩尔质量
铵离子 (NH4+) 的摩尔质量为 18.04 g/mol。该值是通过将 1 个氮原子(14.01 g/mol)和 4 个氢原子(各 1.01 g/mol)的原子质量相加计算得出的。摩尔质量是铵离子的一个重要属性,因为它允许将其质量转换为摩尔,反之亦然。这在许多化学计算中很有用,例如确定化学反应所需的反应物的量。
铵离子的沸点
由于铵离子通常存在于盐中,例如氯化铵 (NH4Cl),因此它本身没有沸点。相反,氯化铵的沸点为 520 °C,它受到多种因素的影响,例如铵离子和氯离子之间的离子键强度以及铵离子的大小和形状。
铵离子的熔点
与沸点类似,铵离子没有熔点,因为它不是以纯净形式存在的物质。然而,含有铵离子的盐,如硝酸铵 (NH4NO3),熔点为 169.6°C。硝酸铵的熔点受铵离子和硝酸根离子之间的离子键强度以及化合物的晶体结构的影响。
铵离子密度g/ml
铵离子 (NH4+) 的密度不适用,因为它是多原子离子,不作为单独的实体存在。然而,含有铵离子的盐,例如硫酸铵 (NH4)2SO4,在室温下的密度为 1.77 g/cm3。含有铵离子的盐的密度受多种因素影响,包括离子的大小和形状、离子键的强度以及化合物的晶体结构。
铵离子的分子量
铵离子 (NH4+) 的分子量为 18.04 g/mol,通过将 1 个氮原子和 4 个氢原子的原子质量相加计算得出。分子量是铵离子的一个重要属性,因为它允许将其质量转换为摩尔,反之亦然。这在许多化学计算中很有用,例如确定化学反应所需的反应物的量。
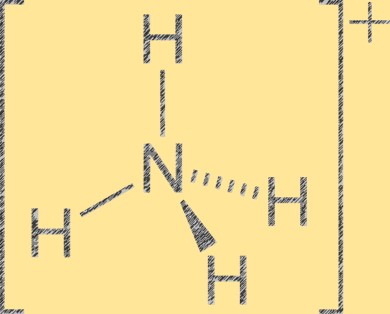
铵离子的结构
铵离子 (NH4+) 具有四面体分子几何形状,中心有一个氮原子,四角有四个氢原子。氮原子的正电荷为+1,而每个氢原子的正电荷为-1。铵离子是氨(NH3)与氢离子(H+)质子化形成的多原子阳离子。铵离子是无机和有机化合物(包括化肥、药品和炸药)中的常见阳离子。
| 外貌 | 白色或无色结晶固体气体 |
| 比重 | 不适用(多原子离子) |
| 颜色 | 无色 |
| 闻 | 无味 |
| 摩尔质量 | 18.04 克/摩尔 |
| 密度 | 不适用(多原子离子),盐密度各不相同(例如,硫酸铵为 1.77 g/cm3) |
| 融合点 | 不适用(多原子离子),盐的熔点各不相同(例如硝酸铵为 169.6°C) |
| 沸点 | 不适用(多原子离子),盐的沸点各不相同(例如氯化铵为 520 °C) |
| 闪点 | 不适用(多原子离子) |
| 水中溶解度 | 极易溶于水(完全混溶) |
| 溶解度 | 溶于醇和液氨 |
| 蒸汽压力 | 不适用(多原子离子) |
| 蒸气密度 | 不适用(多原子离子) |
| 酸度 | 9.25(共轭酸,铵阳离子) |
| 酸碱度 | 7(中性)水溶液 |
注:表中呈现的值可能因铵离子的化学形态和具体条件而异。
铵离子的安全性和危险性
纯净形式的铵离子通常被认为是安全且无毒的。然而,与许多化合物一样,铵离子可能会造成一定的危险和风险,特别是如果处理或使用不当。铵离子与强碱或强酸反应时会释放出有毒的氨气。当暴露于热或火焰时,还可能引起火灾和爆炸危险。此外,接触高浓度的铵离子或其衍生物会刺激眼睛、皮肤和呼吸系统。遵循适当的安全协议并小心处理铵离子及其衍生物以避免潜在危险非常重要。
| 危险符号 | 没有指定纯铵离子 |
| 安全说明 | 吞咽、吸入或通过皮肤吸收有害。对皮肤、眼睛和呼吸道造成刺激。可能释放有毒氨气。可能存在火灾和爆炸危险。 |
| 识别码 | 3077(用于铵化合物,包括铵盐) |
| 海关编码 | 2827.10.00(氯化铵、碳酸铵和其他铵盐) |
| 危险等级 | 9(其他危险物质和物体)针对铵化合物,8 类(腐蚀性物质)针对氢氧化铵溶液 |
| 包装组别 | III(对于铵化合物) |
| 毒性 | 通常认为其纯净形式无毒,但会释放有毒的氨气。铵化合物和衍生物可能对人类健康和环境有毒或有害,具体取决于其特定性质和用途。 |
铵离子的合成方法
铵离子可以使用多种方法合成,包括化学反应和生物过程。
合成铵离子的常用方法是使氨气与酸(例如盐酸或硫酸)反应以产生铵盐。该反应涉及氨分子置换酸中的氢离子 (H+),从而形成铵阳离子 (NH4+) 和相应的酸阴离子(例如氯离子、硫酸根)。可以将所得铵盐纯化并结晶以获得铵离子。
生物过程,例如微生物对有机物的分解,也会导致铵离子的形成。在此过程中,含氮化合物被细菌和其他微生物分解,产生氨并最终产生铵离子。这个过程称为氨化,是氮循环中的重要步骤。
合成铵离子的另一种方法是使用哈伯-博世工艺,该工艺涉及氮气和氢气在催化剂存在下在高压和高温下反应。然后产生的氨气可以与酸反应产生铵离子。
铵离子的用途
铵离子在工业、农业和实验室环境中具有多种用途。
它适用于广泛的工业、农业和实验室环境,因为它主要作为农业肥料,为植物提供容易获得的氮,同时降低土壤 pH 值。
化学工业使用铵离子作为生产各种化合物(例如化肥、炸药和药品)以及抗生素和其他药品合成的关键成分。铵离子还以硝酸铵的形式充当炸药。
在实验室中,研究人员在许多化学反应(例如沉淀反应和有机合成)中使用铵离子作为反应物,并作为缓冲剂来稳定溶液的 pH 值。
此外,由于铵离子能够杀死细菌和真菌,因此在家庭清洁产品中用作抗菌剂。
铵离子的多种用途及其多功能性使其成为各种行业和应用中必不可少的化合物。
