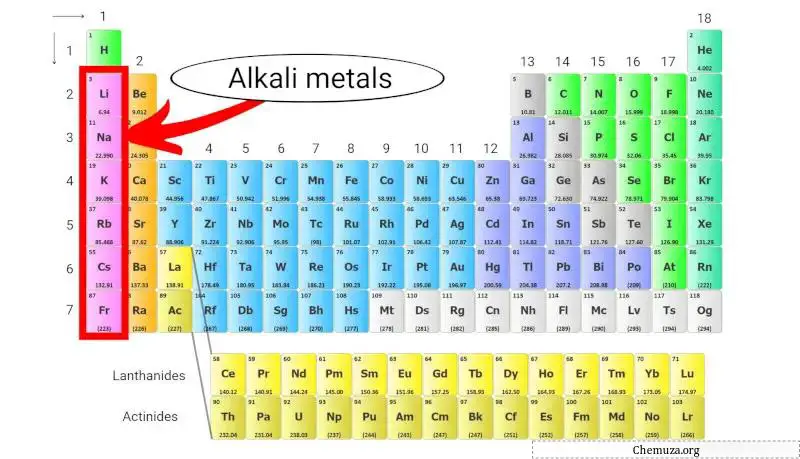
碱金属是一组位于元素周期表第一列的化学元素。该组包括锂、钠、钾、铷、铯和钫。
碱金属很软,熔点和沸点较低。它们常用于电池、合金和各种化学反应。
让我们更多地了解元素周期表中的碱金属。
什么是碱金属?

碱金属是元素周期表中属于第 1 族的一组化学元素。
这些元素以其柔软、低熔点、高反应性以及与水反应时形成碱性溶液的能力而闻名。
碱金属的一些关键特性包括:
- 它们具有低电负性和电离能,这意味着它们很容易失去电子并形成阳离子。
- 它们的熔点和沸点较低,因此相对较软且易于熔化。
- 它们与水和氧气具有很高的反应活性,使其在空气和水中也能发生反应。
- 它们是热和电的良导体。
为什么碱金属这么称呼?

碱金属之所以被称为碱金属,是因为它们与水反应时能够形成强碱性(碱性)溶液。 [1]
当这些金属与水接触时,它们会释放氢气并形成氢氧根离子,使溶液的pH值呈碱性。
解释:
碱金属与水的反应性是由于它们的电离能低[2] ,这意味着它们能够很容易失去电子并形成正离子(阳离子)。
当它们与水接触时,会发生化学反应,失去电子并与水分子反应形成氢氧根离子和氢气。
该反应释放大量热量,可能导致氢气点燃并爆炸。
碱金属的反应活性顺序
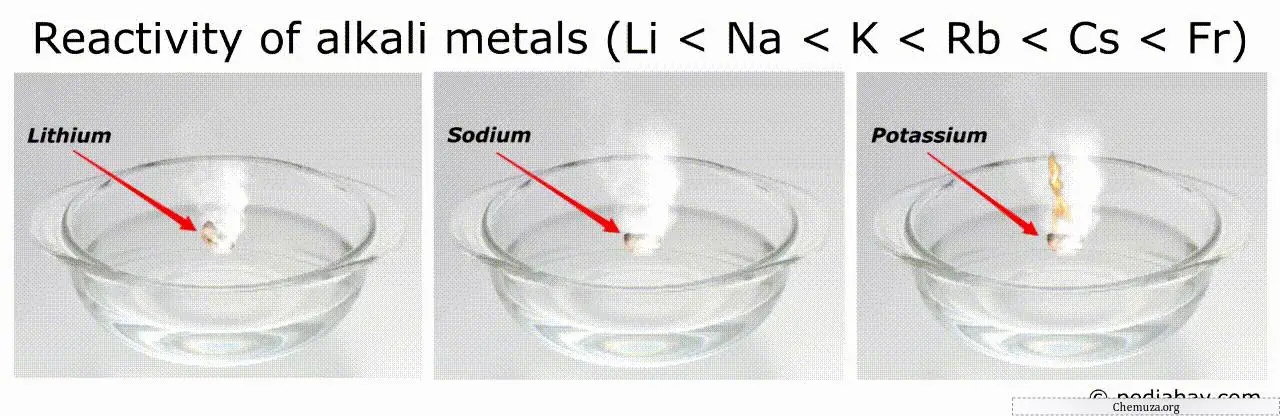
碱金属的反应性顺序的总体趋势是,随着从锂 (Li) 向下移动到钫 (Fr),它会增加。
这意味着钫是所有碱金属中反应性最强的,而锂是反应性最低的。
出现这种趋势的原因是,当元素向下移动时,元素的原子半径增大,而电离能减小。
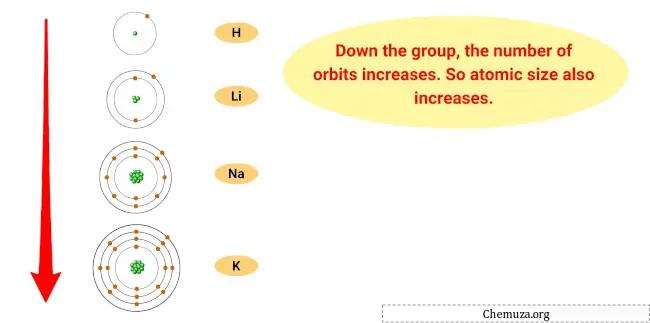
这意味着原子最外层的电子距离原子核更远,并且保持得不太紧,使得元素更容易失去该电子并成为阳离子。
钫是该族中最大且关系最不密切的元素,因此反应性最强。
这种反应顺序对碱金属的性质和行为具有重要意义。
例如,最具反应性的金属(如钫和铯)可以在空气或水中自燃,这使得处理它们非常危险。[3]
相反,活性较低的金属(如锂)更稳定,可用于需要更稳定金属的应用。
碱金属及其电子排布列表
碱金属及其电子构型如下所示。
| 元素 | 电子配置 |
| 锂 (Li) | [它] 2s 1 |
| 钠(Na) | [做] 3秒1 |
| 钾 (K) | [Ar] 4s 1 |
| 铷 (Rb) | [Kr] 5s 1 |
| 铯 (Cs) | [Xe] 6s 1 |
| 钫 (Fr) | [Rn] 7s 1 |
碱金属的周期性趋势
碱金属的周期趋势如下:
- 化合价趋势:碱金属的化合价始终为+1,这意味着它们倾向于失去电子形成稳定的阳离子。因此,当碱金属在族中向下移动时,其化合价没有变化。它们都具有相同的化合价(即1)。
- 原子尺寸趋势:碱金属的原子尺寸随着族群的向下而增加,这意味着原子变得更大。这是因为当你增加能级时,电子云的大小就会增加。
- 金属特性趋势:碱金属的金属特性随着族群的深入而增强。这是因为金属变得更具正电性并且更能够提供电子以形成金属键。
- 电负性趋势:碱金属的电负性随着族群的向下而降低。这是因为原子变得更大,外层电子距离原子核更远,因此它们对原子核的吸引力减弱。
- 电子亲和力趋势:碱金属的电子亲和力随着族群的向下而降低。事实上,在基团的底部,原子的尺寸增加,这降低了原子接受电子的倾向。 (在此处阅读有关电子亲和力趋势的更多信息,以进行详细了解)。
- 电离能趋势:碱金属的电离能随着族群的下降而降低。这意味着更容易从原子的最外层去除电子,因为电子距离原子核更远,并且被束缚得不太紧。
概括
碱金属是一组化学元素,以其柔软、低熔点、高反应性以及与水反应时能够形成碱性溶液而闻名。
由于原子半径增加和电离能降低,碱金属的反应性顺序随着从锂向下移动到钫而增加。
碱金属的周期性趋势包括原子尺寸和金属特性随着族群向下移动而增加,以及电负性、电子亲和力和电离能的降低。
碱金属的化合价始终为+1,其电子构型遵循[稀有气体] ns 1模型。
