硝酸钙是一种化合物,化学式为Ca(NO3)2。它是一种无色无味的固体,极易溶于水。硝酸钙通常用作肥料和废水处理。它还用于生产混凝土、作为炸药的成分以及用于制造各种其他化学品。
| 国际纯粹和应用化学联合会名称 | 二硝酸钙 |
| 分子式 | 钙(NO3)2 |
| CAS 号 | 10124-37-5 |
| 同义词 | 四水硝酸钙、硝酸钙盐、硝基方解石、挪威硝石、石灰硝石、Norgessalpeter |
| 乙酰胆碱 | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
硝酸钙配方
硝酸钙的分子式是Ca(NO3)2。这意味着每个单位的硝酸钙含有一个钙离子(Ca²⁺)和两个硝酸根离子(NO3⁻)。硝酸钙公式通常用于确定化合物的摩尔质量和其他性质。
硝酸钙 摩尔质量
硝酸钙的摩尔质量为 164,088 g/mol。它是由Ca+2和NO3-离子组成的盐,分子式为Ca(NO3)2。化合物的摩尔质量是一摩尔该式化合物的质量(以克为单位),等于其重量。对于 Ca(NO3)2,分子式量是化合物中所有原子的原子量之和。
硝酸钙的沸点
Ca(NO3)2 的沸点较高,为 132 摄氏度。这意味着将固体化合物转化为气体需要大量的能量。 Ca(NO3)2 的高沸点是由于其离子性质,导致 Ca+2 和 NO3- 离子之间存在强静电相互作用。
硝酸钙熔点
Ca(NO3)2的熔点为561摄氏度。这对于盐来说相对较高,并且再次反映了 Ca+2 和 NO3- 离子之间的强离子相互作用。 Ca(NO3)2 的熔点使其成为一种适用于高温应用的有用化合物,例如在肥料或炸药的制造中。
硝酸钙密度g/ml
Ca(NO3)2 的密度根据其形状而变化。例如,无水Ca(NO3)2的密度约为2.5g/cm3,而四水合物(Ca(NO3)2.4H2O)的密度约为1.82g/cm3。与许多其他盐相比,这些值使 Ca(NO3)2 成为相对致密的化合物。
硝酸钙分子量
Ca(NO3)2 的分子量为 164.088 g/mol。该值是化合物中所有原子的原子量之和,其中包括两个氮原子、六个氧原子和一个钙原子。
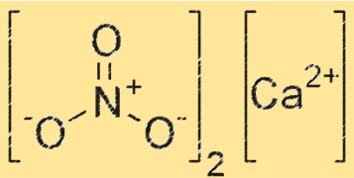
硝酸钙的结构
Ca(NO3)2 具有离子结构,钙离子 (Ca²⁺) 被六个呈八面体排列的氧原子包围。 NO3- 离子也存在于晶格中,NO3- 离子的每个氧原子与Ca+2 离子形成配位键。 Ca(NO3)2 的结构与其他离子化合物(例如氯化钠)的结构相似。
| 外貌 | 白色晶体或粉末 |
| 比重 | 2.5(无水); 1.82(四水合物) |
| 颜色 | 无色(无水);白色(四水合物) |
| 闻 | 无味 |
| 摩尔质量 | 164,088 克/摩尔 |
| 密度 | 2.5克/立方厘米(无水); 1.82 克/立方厘米(四水合物) |
| 融合点 | 561℃(无水); 45°C(四水合物) |
| 沸点 | 132°C(分解) |
| 闪点 | 不适用 |
| 水中溶解度 | 121.2克/100毫升(0℃); 126.7克/100毫升(20℃); 179.6克/100毫升(100℃) |
| 溶解度 | 溶于水、乙醇、甲醇 |
| 蒸汽压力 | 可忽略不计(无水) |
| 蒸气密度 | 不适用 |
| 酸度 | 不适用 |
| 酸碱度 | 4.5-7.5(10%溶液) |
硝酸钙的安全性和危险性
如果处理不当,硝酸钙 (Ca(NO3)2) 可能会造成多种危险。它是一种强氧化剂,与可燃材料接触会引起火灾或爆炸。该化合物接触后还可能引起皮肤和眼睛刺激,吸入粉尘可能引起呼吸道刺激。 Ca(NO3)2 应储存在阴凉、干燥的地方,远离热源,在没有采取适当预防措施的情况下,不得与其他化学品混合。处理 Ca(NO3)2 时应佩戴手套和护目镜等个人防护装备,以避免接触皮肤或眼睛。如果意外摄入,应立即就医。
| 危险符号 | 氧化剂 (GHS05)、刺激物 (GHS07) |
| 安全说明 | S22:不要吸入粉尘/烟雾/气体/烟雾/蒸气/气溶胶。 S26:如不慎接触眼睛,请立即用大量清水冲洗并咨询医生。 S36/37/39:穿戴适当的防护服、手套和眼部/面部防护装置。 |
| AN 标识符 | UN1454(无水硝酸钙)、UN1455(四水硝酸钙) |
| 海关编码 | 283429 |
| 危险等级 | 5.1(氧化剂) |
| 包装组别 | 三、 |
| 毒性 | 口服 (LD50):3,420 mg/kg(大鼠);经皮 (LD50):> 5,000 mg/kg(兔子);吸入 (LC50):>4.8 mg/l/4h(大鼠) |
硝酸钙的合成方法
根据具体应用和所需纯度,有多种合成 Ca(NO3)2 的方法。
常见的方法是碳酸钙与硝酸反应生成 Ca(NO3)2 和二氧化碳:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
另一种方法是氢氧化钙与硝酸反应:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
硝酸和氧化钙之间的反应生成 Ca(NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
所得Ca(NO3)2可通过重结晶或加入少量硫酸除去铁、铝等杂质进一步纯化。
制造商可以通过金属钙与硝酸反应或氢氧化钙与硝酸铵反应来生产 Ca(NO3)2。然而,由于与活性金属或硝酸铵相关的成本较高或安全问题,他们很少使用这些方法。
硝酸钙的用途
- 农业上用作肥料,为植物生长提供钙、氮营养。
- 用作多种混凝土和水泥的成分,以提高其强度和耐久性。
- 用作废水处理化学品生产中的添加剂,有助于去除水中的磷和氮化合物。
- 由于其氧化特性,用于生产多种炸药和烟花。
- 在尼龙和其他合成纤维等各种化学品的生产中用作钙和氮的来源。
- 在工业应用中用作铝和钢等金属的腐蚀抑制剂。
- 用于肉类保鲜和作为食品添加剂以提高某些食品的质量。
- 用于生产军用和民用烟雾弹和照明弹。
- 用于制造某些肥料。还与其他化合物结合使用,为作物提供均衡的养分供应。
- 用作一些特种水族箱肥料的成分,为水生植物提供必需的营养。
问题:
问:Ca(NO3)2 的名称是什么?
答:Ca(NO3)2 的学名是硝酸钙。
问:Ca(NO3)2 溶于水吗?
答:是的,Ca(NO3)2 极易溶于水。室温下,100克水最多可溶解121克硝酸钙。
问:哪里可以买到硝酸钙?
答:Ca(NO3)2 可以从各种化学品供应商处购买,包括在线和商店。购买 Ca(NO3)2 的一些常见地点包括科学供应公司、农场供应商店以及家庭和园艺中心。确保供应商信誉良好、产品质量高且适合预期应用非常重要。
