碳化钙是一种化合物,化学式为CaC2。主要用于生产乙炔气和氰氨化钙。与水反应生成乙炔气和氢氧化钙。人们用它来焊接和照明。
| 国际纯粹和应用化学联合会名称 | 乙炔钙 |
| 分子式 | 碳酸钙 |
| CAS 号 | 75-20-7 |
| 同义词 | 乙炔钙、过碳钙、二碳化钙、卡布罗钙、卡布罗钙、乙炔二化钙 |
| 乙酰胆碱 | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
电石的性质
电石配方
电石的化学式是CaC2。这意味着碳化钙分子由一个钙原子和两个碳原子组成。该式表示化合物中各元素的比例。
碳化钙 摩尔质量
CaC2 的摩尔质量为 64.099 g/mol。这意味着一摩尔 CaC2 的质量为 64,099 克。摩尔质量是通过添加式中元素的原子质量来计算的。钙的原子质量为 40.078 g/mol,碳的原子质量为 12.011 g/mol。
电石的沸点
CaC2的沸点为2300℃。这意味着 CaC2 在此温度下从液体变为气体。沸点受分子间力和大气压力的影响。 CaC2 具有很强的离子键,需要大量能量才能断裂。
电石熔点
CaC2的熔点为2160℃。这意味着 CaC2 在此温度下从固体变为液体。熔点还受到分子间力和大气压力的影响。 CaC2 由于其强离子键而具有高熔点。
电石密度g/ml
CaC2的密度为2.22g/ml。这意味着 1 毫升 CaC2 的质量为 2.22 克。密度是通过质量除以体积来计算的。密度取决于物质中原子或分子的构型和排列。 CaC2 具有高密度,因为其原子在晶体结构中紧密堆积在一起。
电石分子量
CaC2 的分子量为 64,099 amu(原子质量单位)。这意味着 CaC2 分子的质量为 64,099 amu。分子量是通过将式中元素的原子质量乘以它们各自的原子数来计算的。钙的原子质量为40.078 amu,碳的原子质量为12.011 amu。
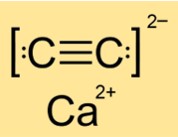
电石结构
CaC2 的结构为四方晶系、单斜晶系或单斜晶系,具体取决于相(I、II 或 III)。这意味着CaC2在不同的状态或条件下其原子或分子具有不同的形状和排列。结构由物质的对称性和几何形状决定。 CaC2 在 I 相中具有四方结构,在 II 相中具有单斜结构,在 III 相中具有另一种单斜结构。
电石的溶解度
CaC2的溶解度在水中迅速水解。这意味着 CaC2 与水快速反应并形成乙炔气体和氢氧化钙作为产物。溶解度是通过在给定温度和压力下可以溶解在给定溶剂中的物质的量来测量的。溶解度取决于物质和溶剂的性质和极性,以及其他因素,例如 pH 值和盐度。
| 外貌 | 白色粉末,带有灰色/黑色晶体或无色结晶固体3 |
| 比重 | 2.22 |
| 颜色 | 无色(纯)或灰色/棕色(技术质量) |
| 闻 | 无味(纯品)或类似大蒜味(工业级) |
| 摩尔质量 | 64,099 克/摩尔 |
| 密度 | 2.22克/立方厘米 |
| 融合点 | 2160℃ |
| 沸点 | 2300℃ |
| 闪点 | 305℃(乙炔) |
| 水中溶解度 | 快速水解 |
| 溶解度 | 不溶于乙醇和乙醚 |
| 蒸汽压力 | 微不足道 |
| 蒸气密度 | 2.21(乙炔) |
| 酸度 | 不适用 |
| 酸碱度 | 不适用 |
电石的安全性和危险性
CaC2 是一种易燃危险化学品。遇水或潮湿时可能引起火灾和爆炸危险。它释放乙炔气体,乙炔气体也是易燃易爆的。 CaC2 也会损害您的健康。这会刺激皮肤、眼睛和肺部。这可能会导致皮疹、眼睛损伤、咳嗽和呼吸急促。如果大量吸入,还会导致肺部积液。处理时应避免接触 CaC2 并穿戴防护装备。您还应该将其存放在干燥、密闭的容器中,远离任何火源。
| 危险符号 | F(高度易燃)、C(腐蚀性)、W(与水发生反应) |
| 安全说明 | S2(置于儿童接触不到的地方)、S7/8(保持容器密闭并干燥)、S16(远离火源)、S26(如不慎接触眼睛,请立即用大量清水冲洗并就医)建议)、S36/37/39(穿戴合适的防护服、手套和眼睛/面部防护装置)、S43(发生火灾时,使用干沙或化学干粉)、S45(如果发生事故或不适,请寻求帮助)立即就医) |
| 联合国识别号 | 联合国1402 |
| 海关编码 | 28491000 |
| 危险等级 | 4.3 |
| 包装组别 | 我 |
| 毒性 | 大鼠口服 LD50:80 mg/kg,大鼠吸入 LC50:1000 ppm/4h |
电石合成方法
从钙和碳氧化物源合成 CaC2 有不同的方法。
最常见的方法之一是电弧炉法。在此过程中,电弧将石灰和焦炭的混合物加热至 2,200°C 左右。该反应是吸热反应并产生熔融的 CaC2 和一氧化碳。熔化后,CaC2 冷却,人们根据其预期用途将其研磨成碎片或粉末。该方法能耗高,设备成本高。
另一种方法是固态方法。要执行此方法,请将氧化钙和生物炭或生物质衍生木炭的混合物在烤箱中加热至约 1,750°C。该反应为固-固反应,生成固体 CaC2 和一氧化碳。您可以直接使用或进一步加工 CaC2 固体。该方法比电弧炉法能耗和设备成本低。
第三种方法是煤焦电能质量替代法。为了进行该过程,将低品位煤和石灰混合,形成颗粒,然后在 1000°C 的烘箱中热解。产生的气体发电,热颗粒被转移到 2000°C 的 CaC2 烘箱中。该反应是固-固反应,产生熔融的 CaC2 和一氧化碳。冷却后,熔融的CaC2经过研磨形成块状或粉末。该方法比电弧炉法具有更高的能源效率和资源利用率。
电石的用途
- 当CaC2与水反应时,生成乙炔气和氢氧化钙。乙炔气是合成许多有机化学品和聚合物的重要中间体,如聚氯乙烯、醋酸乙烯酯、1,4-丁二醇等。氢氧化钙是一种具有多种用途的多功能化合物。
- 为了生产氰氨化钙,人类在高温下将 CaC2 与氮气反应。氰氨化钙可用作氮肥、除草剂和落叶剂。
- 为了降低铁、铸铁、铸铁和钢中的硫含量,使用CaC2。这种化合物与硫反应形成硫化钙,有效地对金属进行脱硫。该工艺提高了钢材的质量和延展性。
- 碳化物灯使用 CaC2 产生乙炔气体,乙炔气体燃烧时会发光。在电灯普及之前,这些灯在采矿、洞穴、自行车和汽车行业很流行。
- 人们使用 CaC2 作为香蕉、芒果和木瓜等水果的催熟剂。它释放乙烯气体,加速成熟过程并增强水果的颜色和甜味。许多国家认为使用 CaC2 残留物来催熟水果的做法非法且有害,因为它会带来健康风险。
- 人们在竹炮和大爆炸炮中使用CaC2来发出巨大的声音。当与水混合时,它会产生乙炔气体,乙炔气体点燃后可为所有人创造有趣的节日体验。
- 也用作炼钢中的脱氧剂。它可以去除钢水中的氧气,并防止形成影响钢产品质量的氧化物。
问题:
问: 国内哪里可以买到电石?
答:您可能可以在您所在地区的一些五金店或焊接用品店找到少量的 CaC2。然而,如果您需要大量 CaC2,最好直接从制造商进口。您可以在线联系一些供应商。
问:如何去除电石?
答:CaC2 是一种危险废物,必须妥善处置。请勿将其扔进垃圾桶或下水道,因为它会与水反应并产生乙炔气体,乙炔气体易燃易爆。您应该联系当地的危险废物管理机构或获得许可的废物处置公司,以获取有关如何安全处置 CaC2 的建议。可能需要在通风良好的地方用水中和,然后包装在密封容器中运输。
问:电石与重水反应生成什么?
答:重水是含有氘而不是氢的水。氘是氢的一种同位素,其原子核中有一个质子和一个中子。当CaC2与重水反应时,会形成氢氧化钙和氘代乙炔。氘代乙炔是含有氘而不是氢的乙炔。该反应的化学方程式为:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
问:电石有危险吗?
答:是的,CaC2 很危险,应小心处理。当与水或湿气接触时,它会释放乙炔气体,从而引起火灾和爆炸危险,乙炔气体也是易燃易爆的。它还会损害您的健康,因为它会刺激您的皮肤、眼睛和肺部。 CaC2 可引起皮疹、眼睛损伤、咳嗽和呼吸短促。如果大量吸入,还会导致肺部积液。处理时应避免接触 CaC2 并穿戴防护装备。您还应该将其存放在干燥、密闭的容器中,远离任何火源。
问:碳化钙是离子型还是共价型?
答:CaC2是离子化合物。它由钙离子(Ca2+)和碳化物离子(C22-)组成。当金属原子失去电子而非金属原子获得电子以实现稳定的电子构型时,就会形成离子化合物。产生的离子通过静电吸引力结合在一起。 CaC2 具有很强的离子键,需要大量能量才能断裂。
问:电石是如何制造的?
答:CaC2 是通过在电弧炉中将石灰(氧化钙)和焦炭(碳)的混合物加热至约 2200°C 获得的。该反应是吸热反应并产生熔融的 CaC2 和一氧化碳。然后将熔融的 CaC2 冷却并研磨成碎片或粉末。该方法能耗高,设备成本高。还有其他方法使用不同的碳源,例如生物炭或低阶煤,以及不同的加热方法,例如固态加热或感应加热。这些方法比电弧炉法具有更低的能耗和设备成本。
问:碳酸钙可以变成电石吗?
答:不可以,碳酸钙不能直接转化为 CaC2。碳酸钙是一种稳定的化合物,在高温下不与碳发生反应。碳酸钙必须首先在没有空气的情况下强烈加热(煅烧),转化为氧化钙。然后氧化钙与碳在高温下反应生成CaC2(渗碳)。该过程的总体化学方程式为:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
问:下列反应中哪一项是正确的? Ca(s) + 2C(s) -> CaC2(s) + 62.8 kJ
答:关于该反应,下列说法正确的是:
- 它是两种或多种元素结合形成化合物的合成反应。
- 这是放热反应,热量释放到环境中。
- 这是氧化还原反应,其中钙被氧化,碳被还原。
- 这是氧化钙和碳形成CaC2 的逆反应。
问:cac2(s) 的标准生成热是多少?
答:cac2(s) 的标准生成热是在 25°C、1 个大气压下,标准状态下的元素生成 1 摩尔 CaC2 时的焓变。它可以使用赫斯定律从给定的热化学方程计算出来。 CaC2 形成的总方程为:
Ca(s) + 2C(s) -> CaC2(s)
利用赫斯定律,我们可以写出:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414.79 kJ + 65.19 kJ + 462.30 kJ – 221.00 kJ – 571.80 kJ = -680.10 kJ
因此,cac2(s)的标准生成热为-680.10 kJ/mol。
问:需要多少克 cac2 才能生成 0.35 摩尔六氯环己烷(g)?
答:要回答这个问题,我们需要使用CaC2与水反应的平衡方程:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
从这个方程我们可以看出,一摩尔 cac2 产生一摩尔六氯环己烷(也称为乙炔)。因此,要生成 0.35 摩尔六氯环己烷,我们需要 0.35 摩尔 cac2。要将摩尔转换为克,我们需要使用 cac2 的摩尔质量,即 64.099 g/mol。通过将摩尔数乘以摩尔质量,我们得到:
0.35 摩尔 x 64.099 克/摩尔 = 22.435 克
因此,我们需要 22.435 克 cac2 才能生成 0.35 摩尔六氯环己烷。
问:需要多少摩尔的 cac2 才能与 49.0 克水完全反应?
答:要回答这个问题,我们需要用电石与水反应的平衡方程:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
从这个方程我们可以看到一摩尔的 cac2 与两摩尔的水反应。因此,为了找到所需的 cac2 摩尔数,我们需要将 h2o 的摩尔数除以二。要将克转换为摩尔,我们需要使用水的摩尔质量,即 18.015 g/mol。通过将克数除以摩尔质量,我们得到:
49.0 克 / 18.015 克/摩尔 = 2.72 摩尔
将其除以二得到:
2.72 摩尔 / 2 = 1.36 摩尔
因此,我们需要 1.36 摩尔的 cac2 才能与 49.0 克的水完全反应。
问:电石和水反应的产物是什么?
答:CaC2与水反应的产物是乙炔气和氢氧化钙溶液。
