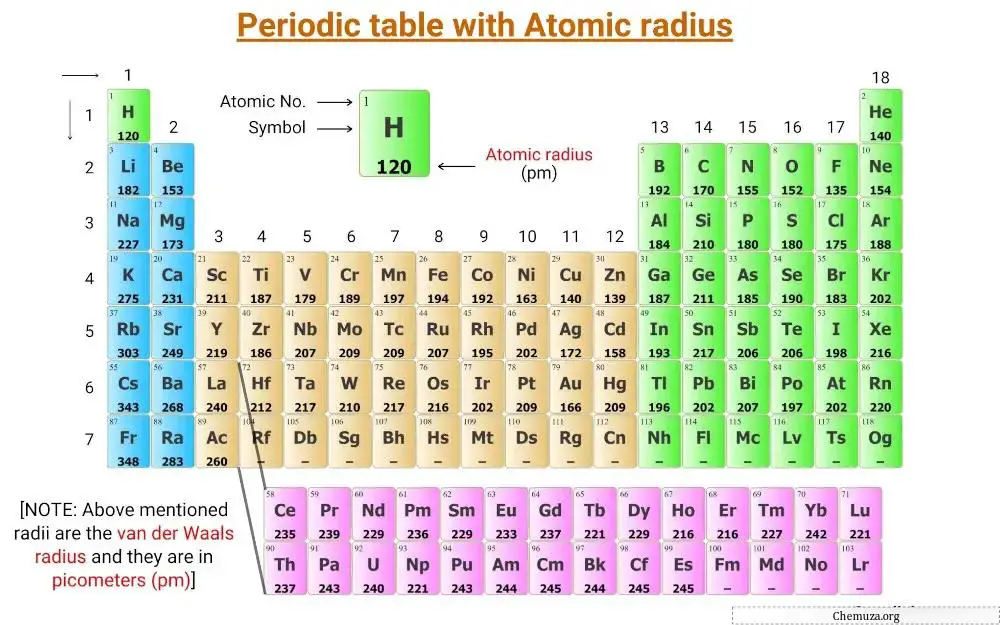
这是一张元素周期表,上面标有元素的原子半径值。
上面元素周期表中提到的半径是范德华半径,单位为皮米(pm)。
嗯,关于元素原子半径,您应该了解一些重要的概念性知识。
那么让我们直接开始吧。
原子半径是多少?
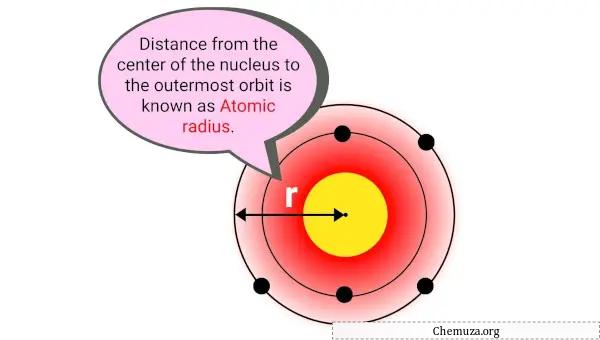
原子半径是原子核中心与其电子云中最外层电子之间的距离。
简单来说,它是原子的大小。原子半径通常以皮米 (pm) 或万亿分之一米为单位进行测量。
原子非常小且难以可视化,但原子半径的概念可以帮助我们理解原子如何相互作用以及它们在不同化学反应中的行为。
原子的大小会影响其化学性质,例如它与其他原子或分子的结合方式。
我们如何测量原子半径?
原子半径通常使用各种实验方法来测量,例如X射线晶体学、电子衍射和光谱学。
这些方法涉及研究原子与某些形式的能量(例如 X 射线或电子)相互作用时的行为。
- 在 X 射线晶体学中,X 射线束瞄准正在研究的元素的晶体。 X 射线使晶体中的原子发生衍射,由此产生的衍射图案可用于确定原子之间的距离,从而确定它们的半径。
- 在电子衍射中,电子束被引导到正在研究的元素的薄膜上。当电子穿过薄膜时,它们会散射原子,产生衍射图案,可以通过分析该图案来确定原子半径。
- 光谱学涉及研究光与物质之间的相互作用。通过分析原子吸收或发射的光的波长,科学家可以确定其原子半径。
影响原子半径的因素
原子的大小受多种因素影响,包括:
- 核电荷
- 电子配置
- 价电子距原子核的距离等
核电荷
原子核中的质子数称为原子序数。 [1]
随着原子序数的增加,原子核中质子的数量增加,从而产生更大的核电荷。
这种增加的电荷将电子更强烈地吸引向原子核,从而导致原子半径更小。
电子配置
电子围绕原子核的排列方式决定了其电子构型。 [2]
电子离原子核越近,原子半径越小。
最外层能级(价层)电子数量较多的原子将具有较大的原子半径,因为电子距离原子核较远且对原子核的吸引力较弱。
价电子距原子核的距离
价电子和原子核之间的距离也会影响原子半径。
随着电子壳层数量的增加,价电子远离原子核,导致原子半径增加。
值得注意的是,影响原子半径的因素是相互关联的。例如,虽然核电荷的增加将导致原子半径变小,但最外层能级(价层)电子数量的增加将导致原子半径变大。因此,原子的总体尺寸是这些因素之间的平衡的结果。
有关更多信息,您应该阅读元素周期表上的原子半径趋势。
概括
原子半径是原子的大小,以皮米为单位测量,从原子核中心到电子云中最外层的电子。
这有助于我们了解原子如何相互作用并影响其化学性质。 X射线晶体学、电子衍射和光谱学等实验方法用于测量原子半径。
影响原子半径的因素有核电荷、电子构型以及价电子与原子核之间的距离。这些因素相互关联并决定原子的总体尺寸。
