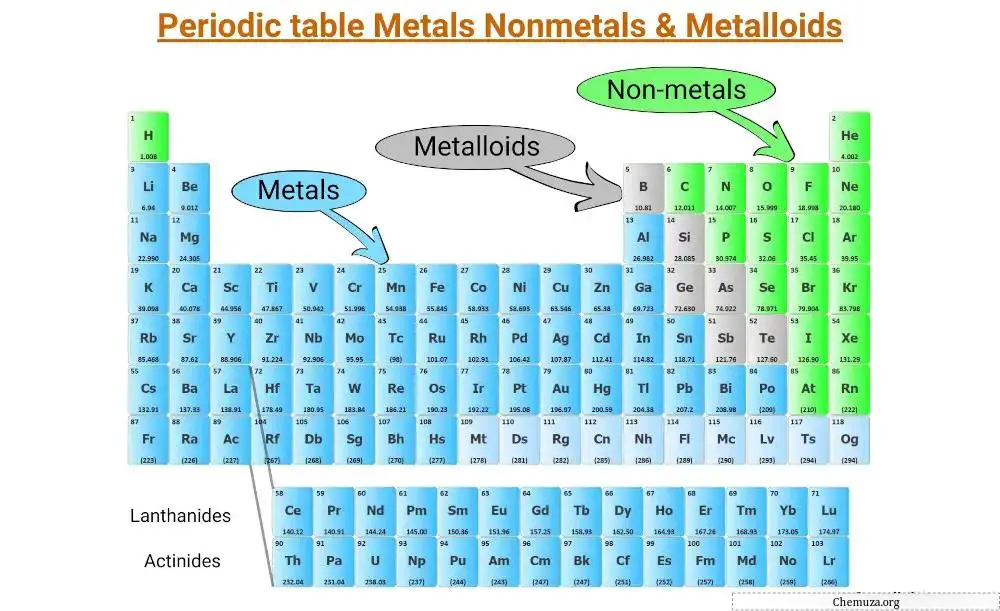
元素周期表中的所有元素可分为 3 个主要类别;
- 金属
- 非金属和
- 类金属
金属通常具有光泽、导电且具有延展性,构成了元素周期表左侧的大部分元素。
另一方面,非金属往往是易碎的(有些是气体)和不良导体,并且主要位于桌子的右侧。
准金属与金属和非金属具有相同的性质,并且位于分隔金属和非金属的“阶梯”上。
让我们更多地探索元素周期表中的金属、非金属和准金属。
金属
金属构成元素周期表中的大部分元素,位于分隔金属与非金属的“阶梯”线的左侧。
金属具有某些特性,例如高导电性、光泽、延展性和延展性。
金属有五种主要类型:
- 碱金属位于元素周期表第 1 族,是一种柔软的、高活性金属,与水发生剧烈反应。
- 第 2 族的碱土金属也具有很强的反应性,但不如碱金属。它们是地壳矿物的重要组成部分。
- 过渡金属位于第 3 族至第 11 族,是一些最著名的金属,包括铁、金和银。它们具有高熔点并且通常含有有色化合物。 [1]
- 位于f区的镧系元素和锕系元素被称为“稀土金属”。它们具有独特的特性,例如磁性和发光特性。 [2]
- 后过渡金属位于 d 和 f 块之外,包括铝、锡、铅等金属。它们被广泛应用于建筑、交通和电子等领域。
总体而言,金属在我们的日常生活中具有许多重要用途,从建筑结构和机械到成为现代技术的重要组成部分。
非金属
非金属是一组不表现出金属特性的化学元素。它们位于元素周期表的右侧,除了位于左上角的氢。
非金属可分为几类,包括:
- 稀有气体:这些是稳定且惰性的元素,也就是说,它们不易与其他元素发生反应。稀有气体包括氦、氖、氩、氪、氙和氡。
- 卤素:这些是高反应性非金属,很容易与其他元素形成化合物。卤素包括氟、氯、溴、碘和砹。
- 其他非金属:包括氢、碳、氮、氧、磷、硫和硒等元素。
非金属具有多种与金属不同的物理和化学特性。
例如,非金属往往是热和电的不良导体,并且它们的熔点和沸点比金属低。
非金属在与金属反应时也倾向于形成负离子,而金属则倾向于形成正离子。 [3]
类金属
类金属是与金属和非金属具有相同性质的元素。
它们位于分隔元素周期表两类的“楼梯”上。
类金属包括以下元素:
准金属往往具有使其在技术和工业应用中有用的特性。
例如,硅是半导体的重要组成部分,而硼则用于生产高强度和轻质合金。 [4]
砷已被用于多种用途,包括用作木材防腐剂和杀虫剂,尽管它现在被认为是有毒物质。 [5]
准金属的关键特性之一是它们在特定条件下的导电能力。
例如,硅是一种半导体,这意味着它可以用来控制电子设备中的电流。
类金属通常也很脆,在压力下会破裂,就像固体非金属一样。
总体而言,准金属的独特性质使其成为各种应用(包括技术和电子产品)中的重要元素。
概括
元素周期表包括三大类元素:金属、非金属和准金属。
金属位于元素周期表的左侧,具有高导电性、光泽、延展性和延展性等特性。
另一方面,非金属位于元素周期表的右侧,通常是易碎且不良的导体。
准金属与金属和非金属具有相同的特性,并且位于分隔两类的“阶梯”上。
