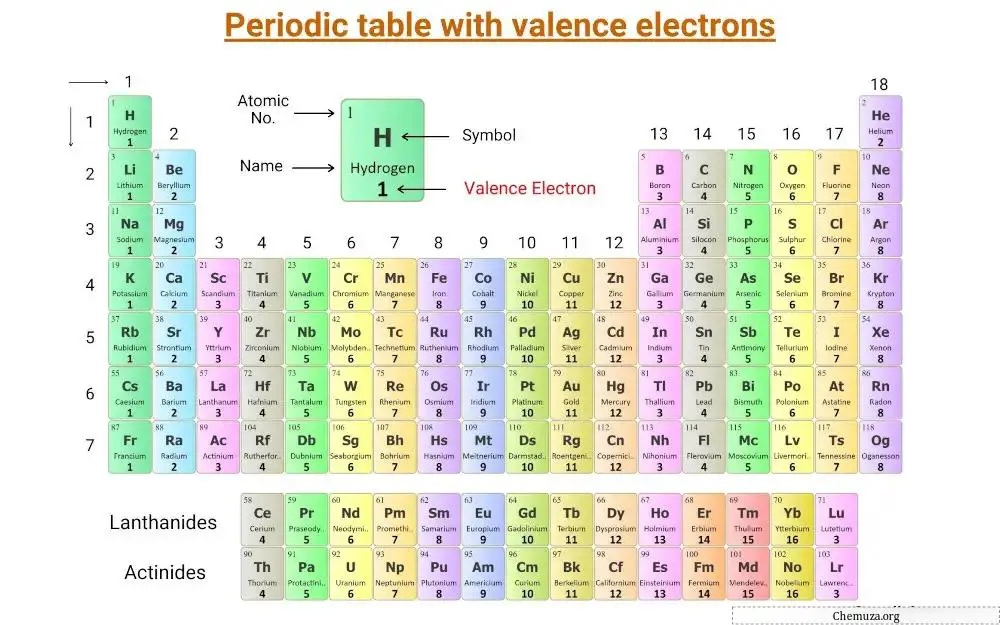
这是标有价电子的元素周期表。
什么是价电子?
例如,镁在其最外层轨道上有2个电子,因此它有2个价电子。 [1]
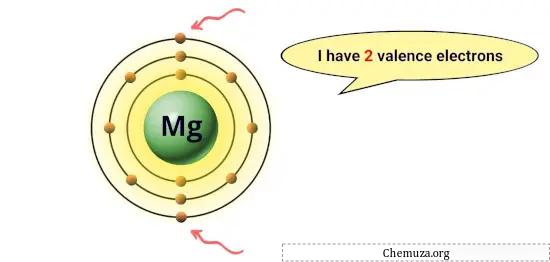
这些电子决定元素的化学性质,例如其反应性以及它可以与其他原子形成的化学键的类型。
原子的价电子数量决定了它在元素周期表中的位置及其形成化学键的能力。
主族元素的价电子
主族元素,也称为代表性元素,位于周期表的第 1、2、13 至 18 族。
这些元素中的价电子数等于它们的族数。
例如,第 1 族元素(例如锂和钠)具有一个价电子,而第 2 族元素(例如镁和钙)具有两个价电子。
这些价电子决定了元素独特的化学性质和反应性。
过渡元素和内部过渡元素的价电子
过渡元素和内过渡元素的价电子的确定比主族元素的价电子更复杂。
事实上,过渡元件的子层d和内部过渡元件的子层f未被完全填充并且非常接近外部子层s。
结果,过渡元素中的 d 和 s 亚壳层以及内部过渡元素中的 f 和 s 亚壳层的电子可以表现得像价电子。
对于过渡元素,由于 d-亚壳层和 s-亚壳层电子的贡献,价电子的范围可以从 3 到 12。在某些情况下,不完整 d 轨道中的电子也被视为价电子。 [2]
类似地,对于内部过渡元素(或 f 区元素),由于 f 亚壳层和 s 亚壳层电子的贡献,价电子的范围可以为 3 到 16。 [3] 不完整 d 轨道中的电子也可以被视为某些内部过渡金属中的价电子。
值得注意的是,对于过渡元素和内部过渡元素,价电子是存在于惰性气体核外部的壳层中的电子。
