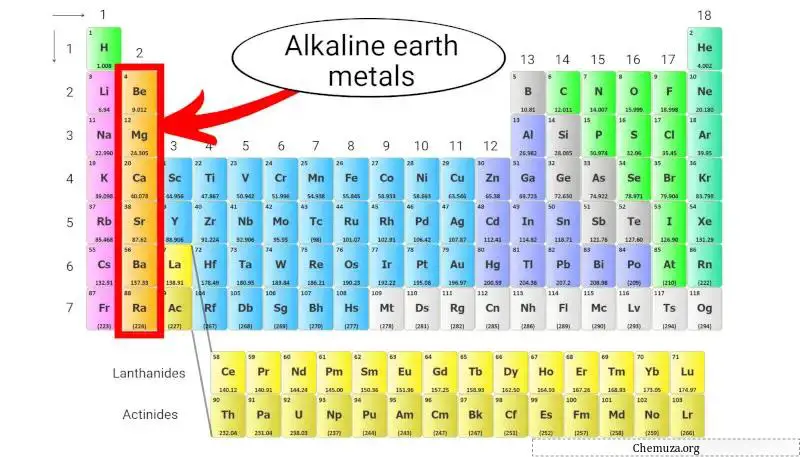
碱土金属是位于元素周期表第二列的一组元素。它们包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba) 和镭(Ra)。
这些金属的最外层有两个电子, [1] ,这使得它们具有化学反应性,但不如第一列中的碱金属那么反应性。
让我们更多地了解元素周期表中的碱土金属。
什么是碱土金属?

碱土金属属于元素周期表第 2 族,具有两个特殊特性。
- 当它们与水反应时,会产生碱性或碱性的氢氧化物。
- 它们的氧化物矿物(BeO、菱镁矿、MgO、绿柱石等)主要存在于地壳中,对热稳定。
解释
当碱土金属(Mg、Ca、Sr、Ba 和 Ra)与水反应时,它们会形成本质上呈碱性的氢氧化物。 [2]
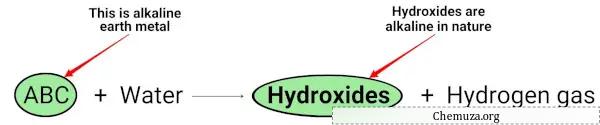
您可以在上面的化学方程式中看到,碱金属产生氢氧化物,氢氧化物本质上是碱性的(pH > 7)并释放氢气。
例如:
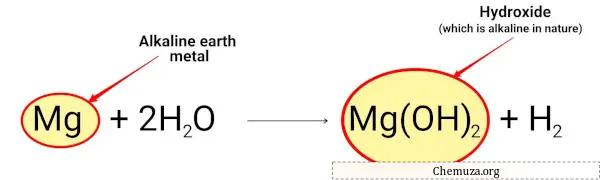
镁与水反应生成氢氧化镁,呈碱性。
此外,这些金属主要存在于地壳中(以氧化物的形式),并且这些氧化矿物具有热稳定性。 [2]
这两个标准将这些金属命名为“碱土金属”。
(注:需要注意的是,铍也是第 2 族元素,与水反应时不会形成碱性溶液。相反,它的氢氧化物表现出两性行为,这意味着它们可以表现得像酸或碱因此,铍不被视为碱土金属,即使它属于同一族。)
所有碱土金属的共同点是什么?
碱土金属有几个共同的特征。
例如,它们的最外层能级都有两个价电子,这使得它们非常具有反应性。
这种反应性是由于化学反应过程中倾向于失去这些电子,导致形成带 +2 电荷的阳离子。
此外,所有碱土金属都具有闪亮的银白色外观。

这是碱土金属的两个主要共同点。
碱金属及其电子排布列表
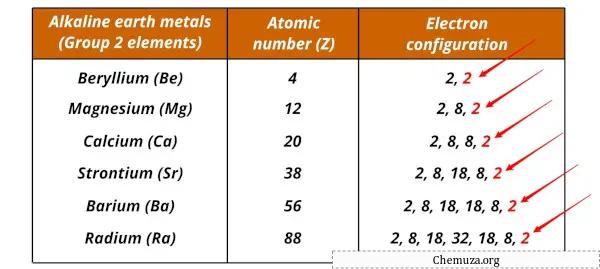
碱土金属及其电子配置如下所示。
| 元素 | 电子配置 |
| 铍 (Be) | [他] 2s 2 |
| 镁 (Mg) | [做] 3秒2 |
| 钙 (Ca) | [Ar] 4s 2 |
| 锶 (Sr) | [克尔] 5s 2 |
| 钡 (Ba) | [Xe] 6s 2 |
| 镭 (Ra) | [Rn] 7s 2 |
碱土金属的周期性趋势
当元素周期表中的碱土金属族向下移动时,可以观察到以下趋势:
- 化合价:所有碱土金属的化合价相同,均为+2。因此,当我们沿着组向下移动时,化合价没有变化。
- 原子尺寸:碱土金属的原子尺寸随着族级的降低而增加。这是因为电子层(或轨道)数量增加,内部电子的屏蔽效应降低了原子核与最外层电子之间的吸引力。
- 金属特性:碱土金属的金属特性随着族群的向下移动而增强。这是因为原子变得更大并含有更多电子,使它们更容易失去电子并形成正离子。
- 电负性:碱土金属的电负性随着族群的降低而降低。这是因为原子变得更大并且具有更多的电子壳层,使得它们更难以吸引电子。
- 电子亲和力:碱土金属的电子亲和力通常较低,并且随着族中向下移动而降低。
- 电离能:碱土金属的电离能随着族群的降低而降低。这是因为较大的原子有更多的电子壳层,最外层的电子离原子核更远,更容易被去除。
概括
碱土金属包括铍、镁、钙、锶、钡和镭。它们的最外层有两个电子,这使得它们具有反应性,但不如碱金属。
这些金属与水反应时会产生碱性氢氧化物,并含有热稳定的氧化矿物质。所有碱土金属共有的主要特征是具有两个价电子,呈银白色且有光泽,并形成带+2电荷的阳离子。
当原子团向下移动时,化合价保持不变,但原子尺寸和金属特性增加,而电负性、电子亲和力和电离能降低。
