什么是氨?
氨或NH3是一种无色、有刺激性的气体,由氮气和氢气组成,在工业中广泛用作制冷剂、清洁剂和肥料。
| 国际纯粹和应用化学联合会名称 | 氨 |
| 分子式 | 氨 |
| CAS 号 | 7664-41-7 |
| 同义词 | 氮杂氮、三氢化氮、Hartshorn 醇 |
| 乙酰胆碱 | InChI=1S/NH3/c1-2 |
氨的性质
氨的路易斯结构
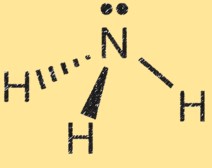
氨 (NH3) 的路易斯结构显示了分子中电子的排列。在路易斯结构中,点代表电子,线代表原子之间的键。
氨的路易斯结构显示氮原子被三个氢原子包围,氮原子和氢原子之间共享一对电子。这代表分子中的共价键。氮原子有五个价电子,氢原子各有一个价电子。在氨的路易斯结构中,氮原子与氢原子形成三个单键,并具有一对不共享的电子。
氨配方
氨的化学式是NH3。该式表明每个氨分子中有3个氢原子和1个氮原子。该公式代表了物质的组成,并提供了有关其性质和行为的重要信息。
NH3 摩尔质量
物质的摩尔质量是一摩尔物质的质量,以克/摩尔表示。氨 (NH3) 的摩尔质量为 17.0307 g/mol。这意味着一摩尔氨的质量为 17.0307 克。物质的摩尔质量对于确定给定样品中的摩尔数很重要,并且可用于确定化合物的分子式质量。
氨的沸点
NH3 的沸点为 -33.34°C (-28.012°F)。物质的沸点是其蒸气压等于大气压并且开始从液体转变为气体时的温度。与其他化学品相比,NH3 的沸点相对较低,使其成为冷却和制冷系统中有用的制冷剂。
NH3 熔点
NH3 的熔点为 -77.73°C (-107.87°F)。物质的熔点是它从固体转变为液体的温度。 NH3 的低熔点使其成为一种有用的制冷剂,因为它可以很容易地从气体凝结成液体,从而在改变状态时吸收热量。
NH3 密度 g/ml
物质的密度是单位体积样品的质量。 NH3 的密度为 0.769 g/mL。这意味着 1 毫升 NH3 的质量为 0.769 克。物质的密度可用于确定给定体积中存在的物质的量,并且是了解物质在不同状态下如何表现的重要属性。
NH3 分子量
物质的分子量是该物质的单个分子中所有原子的原子量之和。 NH3(NH3)的分子量为17.0307 g/mol。这意味着 NH3 分子的分子量为 17.0307 克/摩尔。物质的分子量对于确定给定样品中的摩尔数很重要,并且可用于确定化合物的分子式质量。
NH3结构式
NH3是由三个氢原子和一个氮原子组成的分子。氮原子通过共价键与氢原子连接,分子呈三棱锥形状。分子中的键角约为107°。 NH3 是一种极性分子,意味着它有正端和负端,通常用作化学反应中的溶剂和试剂。
| 外貌 | 无色气体 |
| 比重 | 0.59(空气=1) |
| 颜色 | 无色 |
| 闻 | 刺激性且强烈的气味 |
| 摩尔质量 | 17.0307 克/摩尔 |
| 密度 | 0.769克/毫升 |
| 融合点 | -77.73℃ |
| 沸点 | -33.34℃ |
| 闪点 | 不适用(气体) |
| 水中溶解度 | 非常易溶 |
| 溶解度 | 溶于水和大多数有机溶剂 |
| 蒸汽压力 | 20°C 时为 50.7 kPa |
| 蒸气密度 | 0.59(空气=1) |
| 酸度 | 4.75 |
| 酸碱度 | 11.6(饱和溶液) |
氨安全和危险
NH3是一种剧毒、腐蚀性气体,如果处理不当,会严重危害人体健康和环境。 NH3 可导致眼睛、皮肤和呼吸道严重烧伤,吸入高浓度还可致命。此外,NH3 具有很强的反应性,如果与某些化学品或材料接触,可能会燃烧或爆炸。
处理或使用 NH3 时,采取安全预防措施非常重要。这包括穿戴防护服,例如手套、护目镜和面罩,以及提供足够的通风以避免吸入气体。将 NH3 储存在通风良好的地方,远离热源和其他易燃材料也很重要。如果接触 NH3,请务必脱掉受污染的衣服并用大量水冲洗受影响的区域。如果出现接触症状,请立即就医。
| 危险符号 | T+、N |
| 安全说明 | 对环境有害、吸入有害、有刺激性 |
| AN 标识符 | 联合国1005 |
| 海关编码 | 2814.1 |
| 危险等级 | 2.3 |
| 包装组别 | 二 |
| 毒性 | 高毒致命剂量(吸入) – 33-66 ppm |
氨合成方法
合成氨有多种方法,包括哈伯法、奥斯特瓦尔德法和伯克兰-艾德法。
哈伯法,也称为哈伯-博世法,是工业合成氨中应用最广泛的方法。在此过程中,空气中的氮气与氢气在铁催化剂上反应形成氨。该反应在高压(约 150 个大气压)和 450-500°C 的温度下进行。哈伯工艺非常高效,可以高产率生产大量氨,并被用作生产化肥和其他化学品的主要氨源。
奥斯特瓦尔德工艺,也称为固氮工艺,是一种较古老的氨合成方法,涉及将氮气氧化成一氧化氮,然后一氧化氮与更多的氮气反应形成氨。该工艺效率较低,已大部分被哈伯工艺所取代。
Birkeland-Eyde 工艺也称为等离子体工艺,是一种较新的氨合成方法,它使用等离子体放电来离解氮气和氢气并形成氨。该工艺仍处于开发阶段,尚未广泛应用于工业用途。
综上所述,哈伯法是最常用的氨合成方法,而奥斯特瓦尔德法和伯克兰-艾德法是较旧或不太广泛使用的方法。
氨的用途
氨是一种用途广泛的化学品,在工业和农业中有着广泛的用途。氨的一些主要用途包括:
- 肥料生产:氨是氮肥生产的主要成分,可提高作物产量并改善土壤肥力。
- 制冷:工业和家用制冷系统使用氨作为制冷剂,包括冰箱和冰柜。
- 清洁:家用清洁产品通常含有氨,因为它能够溶解油脂和污垢。
- 药品:各种药品的生产,如抗酸剂和止咳糖浆,都使用氨作为原料。
- 纺织品生产:纺织品染色和印花以及合成纤维的生产都使用氨。
- 废物处理:污水处理厂的废水处理和气味控制涉及氨的使用。
- 阻燃剂:氨在塑料、橡胶等材料的生产中充当阻燃剂。
- 石油和天然气生产:石油和天然气工业使用氨来生产各种化学品,包括表面活性剂和破乳剂。
总之,氨是一种多功能化学品,在各个行业和应用中具有广泛的用途,包括农业、制冷、清洁、制药、纺织品生产、废物处理、阻燃剂以及石油和天然气生产。
问题:
氨是酸还是碱?
氨被认为是碱。在水溶液中,它溶解形成氢氧根离子(OH-)并充当弱碱。氨具有碱性 pH 值,通常约为 11。氨溶液可以中和酸形成盐和水,这是碱的定义特征之一。在化学反应中,氨还可以充当亲核试剂,参与形成酰胺的反应,酰胺是氨的衍生物,含有胺和酰胺的氮碳键特征。
氨有极性吗
是的,氨是极性的。它具有弯曲的分子几何形状,中心氮原子被三个氢原子包围。这种形状产生永久偶极矩,偶极子的正端位于氢原子处,负端位于氮原子处。氨的极性性质使其能够溶解在水等极性溶剂中,这是极性分子的特征。氨的极性性质也使其能够参与氢键,这是极性分子之间发生的一种分子间力。这种氢键可以导致比类似尺寸的非极性分子更高的沸点和熔点。
