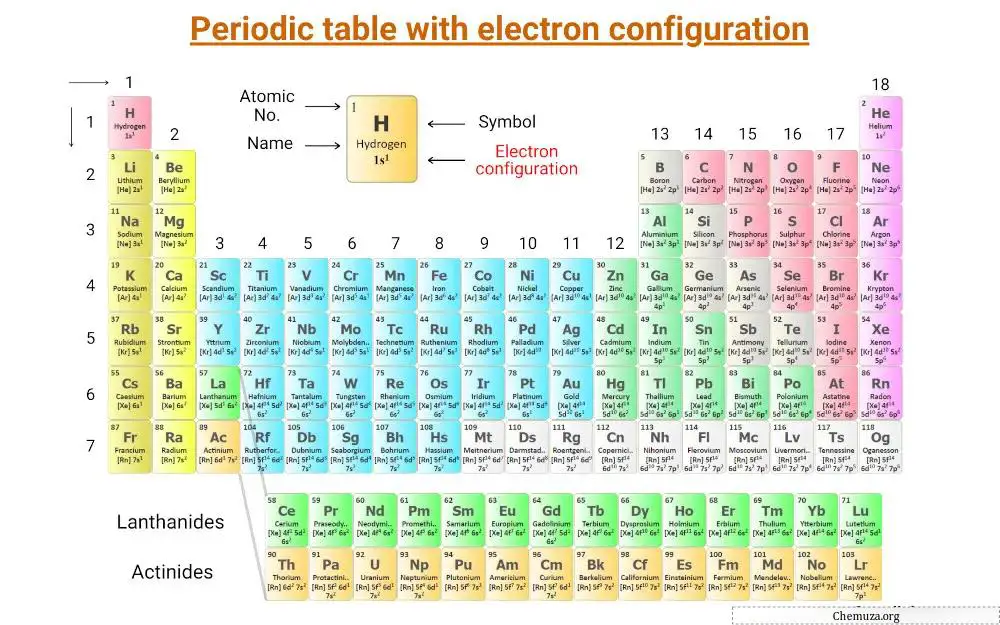
它是一个周期表,上面标明了元素的电子排布。
您还可以从这里下载高清图片;
让我们进一步探讨元素的电子配置;
什么是电子配置?
电子构型是指原子中电子的排列。
电子是微小的带负电粒子,围绕带正电的原子核运行。
原子的电子构型决定了它的化学和物理性质,例如它的反应性、电导率和熔点。
原子中电子的排列由其能级(也称为壳层)和这些壳层内的特定子壳层决定。
电子构型通常使用表示每个壳层和子壳层中电子数量的符号来表示,并遵循基于量子力学原理的某些规则。
什么是壳 (n) 和子壳 (s、p、d、f)?
壳层:壳层是电子围绕原子核旋转的轨道。
每个壳都分配有一个编号 (n),从第一个壳的 1 开始,并随着每个附加壳的增加而增加。
第一个壳层最多只能容纳 2 个电子,而第二个壳层最多可以容纳 8 个电子,后续的壳层可以容纳更多电子。
子壳层(或轨道):每个壳层内有不同的子壳层,使用 s、p、d 和 f 等字母进行标记。
s亚壳最多可容纳2个电子,p亚壳最多可容纳6个电子,d亚壳最多可容纳10个电子,f亚壳最多可容纳14个电子。 [1]
原子的层和亚层决定了它的电子构型,进而决定了它的化学和物理性质。
元素的电子排布(列表)
这是元素周期表前 20 种元素的电子排布列表。
| 原子数 | 元素 | 电子配置 |
| 1 | 氢 (H) | 1秒1 |
| 2 | 氦气 (He) | 1秒2 |
| 3 | 锂 (Li) | [它] 2s 1 |
| 4 | 铍 (Be) | [他] 2s 2 |
| 5 | 硼 (B) | [它] 2s 2 2p 1 |
| 6 | 碳(C) | [他] 2s 2 2p 2 |
| 7 | 氮 (N) | [他] 2s 2 2p 3 |
| 8 | 氧气 (O) | [他] 2s 2 2p 4 |
| 9 | 萤石 (F) | [它] 2s 2 2p 5 |
| 十 | 霓虹灯(氖) | [他] 2s 2 2p 6 |
| 11 | 钠(Na) | [做] 3秒1 |
| 12 | 镁 (Mg) | [做] 3秒2 |
| 13 | 铝 (Al) | [做] 3s 2 3p 1 |
| 14 | 硅(Si) | [不要] 3s 2 3p 2 |
| 15 | 磷(P) | [不要] 3s 2 3p 3 |
| 16 | 硫(S) | [做] 3s 2 3p 4 |
| 17 号 | 氯 (Cl) | [不要] 3s 2 3p 5 |
| 18 | 氩气 (Ar) | [做] 3s 2 3p 6 |
| 19 | 钾 (K) | [Ar] 4s 1 |
| 20 | 钙 (Ca) | [Ar] 4s 2 |
