Le trifluorure de chlore ou ClF3 est un composé chimique hautement réactif et toxique utilisé dans les propulseurs de fusée, les agents de nettoyage et comme agent oxydant dans les réactions chimiques. Il peut provoquer de graves brûlures et s’enflammer spontanément au contact de matières organiques.
| Nom UICPA | Trifluorure de chlore |
| Formule moléculaire | ClF3 |
| Numero CAS | 7790-91-2 |
| Synonymes | Fluorure de chlore, Trifluorochlore, Trichlorofluorure, Fluorochlore, Fluorure de chloryle, Chlorure de fluor |
| InChI | InChI=1S/ClF3/c2-1(3)4 |
Formule de trifluorure de chlore
La formule chimique du trifluorure de chlore est ClF3, qui représente les trois atomes de fluor et un atome de chlore dans la molécule. La formule peut être utilisée pour calculer la masse molaire, la densité et d’autres propriétés physiques du trifluorure de chlore. La formule indique également les types et le nombre d’atomes présents dans le composé, ce qui est important pour comprendre ses propriétés chimiques et sa réactivité.
Trifluorure De Chlore masse molaire
La masse molaire du trifluorure de chlore (ClF3) est 92,45 g/mol. Cette valeur est calculée en additionnant les poids atomiques des éléments constitutifs, qui sont de 35,45 g/mol pour le chlore et de 37,996 g/mol pour le fluor. La masse molaire du trifluorure de chlore est importante dans les calculs chimiques et dans la détermination de la quantité du composé dans un échantillon donné.
Point d’ébullition du trifluorure de chlore
Le trifluorure de chlore a un point d’ébullition de 11,75°C à pression standard. Cela en fait un composé volatil et hautement réactif qui peut facilement se vaporiser et former des fumées toxiques. Le faible point d’ébullition du trifluorure de chlore est attribué aux faibles forces intermoléculaires entre ses molécules, ce qui leur permet de se briser et de s’échapper sous forme de gaz à des températures relativement basses.
Point de fusion du trifluorure de chlore
Le trifluorure de chlore a un point de fusion de -76,3°C (-105,3°F) à pression standard. Cela en fait un solide à température et pression ambiantes, mais il peut facilement se sublimer et former des fumées toxiques en raison de sa forte volatilité. Le faible point de fusion du trifluorure de chlore est attribué aux faibles forces intermoléculaires entre ses molécules, ce qui leur permet de se briser et de devenir un gaz à des températures relativement basses.
Densité du trifluorure de chlore g/ml
La densité du trifluorure de chlore est de 1,77 g/mL à température et pression standard (STP). Cette valeur est supérieure à celle de l’air (1,29 g/mL), ce qui fait du trifluorure de chlore un gaz plus dense que l’air. La densité élevée du trifluorure de chlore est due à son poids moléculaire, qui est supérieur à celui de la plupart des gaz présents dans l’atmosphère.
Poids moléculaire du trifluorure de chlore
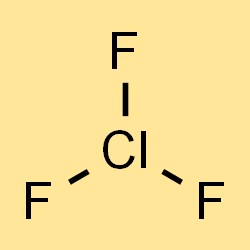
Le poids moléculaire du trifluorure de chlore est de 92,45 g/mol. Cette valeur est calculée en additionnant les poids atomiques des éléments constitutifs, qui sont de 35,45 g/mol pour le chlore et de 37,996 g/mol pour le fluor. Le poids moléculaire élevé du trifluorure de chlore en fait un gaz dense, plus lourd que l’air.
Structure du trifluorure de chlore
Le trifluorure de chlore a une géométrie moléculaire bipyramidale trigonale, avec un atome de chlore central lié à trois atomes de fluor en positions équatoriales et à deux sites vacants en positions axiales. Cette structure donne naissance à une molécule polaire, les deux positions axiales ayant une charge partielle positive et les trois positions équatoriales ayant une charge partielle négative.
| Apparence | Gaz ou liquide jaune incolore à jaune pâle |
| Gravité spécifique | 1,77 |
| Couleur | Incolore à jaune pâle |
| Odeur | Odeur âcre et suffocante |
| Masse molaire | 92,45 g/mole |
| Densité | 1,77 g/mL à STP |
| Point de fusion | -76,3°C (-105,3°F) |
| Point d’ébullition | 11,75 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit violemment avec l’eau |
| Solubilité | Soluble dans l’acide sulfurique, l’acide nitrique et d’autres agents oxydants |
| Pression de vapeur | 1,73 guichet automatique à 20°C |
| Densité de vapeur | 3,2 (air = 1) |
| PKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du trifluorure de chlore
Le trifluorure de chlore est un composé hautement réactif et dangereux. Cela présente de graves risques pour la santé et la sécurité et doit être manipulé avec une extrême prudence. Il peut provoquer de graves brûlures, corrosions et irritations au contact de la peau, des yeux et des muqueuses. L’inhalation de ses vapeurs peut provoquer une détresse respiratoire, de la toux et des douleurs thoraciques. Le trifluorure de chlore peut également s’enflammer et réagir violemment avec les matières organiques, les métaux et l’eau, provoquant des explosions et des incendies. Des équipements de protection spécialisés, tels que des combinaisons et des respirateurs résistants aux produits chimiques, doivent être portés lors de la manipulation du trifluorure de chlore, et ils ne doivent être utilisés que dans un environnement bien ventilé et contrôlé par des professionnels qualifiés.
| Symboles de danger | Corrosif, Oxydant |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles, des flammes nues, des surfaces chaudes et des sources d’inflammation. Portez des vêtements et des équipements de protection. Évitez tout contact avec la peau, les yeux et les vêtements. Ne pas inhaler les fumées ou les vapeurs. Ne pas ingérer. Utiliser uniquement dans un endroit bien ventilé. |
| Identifiants ONU | ONU 1749 |
| Code SH | 281211 |
| Classe de danger | 8 |
| Groupe d’emballage | je |
| Toxicité | Très toxique |
Méthodes de synthèse du trifluorure de chlore
La fluoration directe du chlore gazeux peut synthétiser du trifluorure de chlore. Le fluorure d’hydrogène et le chlore gazeux peuvent réagir pour synthétiser du trifluorure de chlore.
Un mélange de chlore gazeux et de fluor gazeux réagit sur un lit de charbon actif ou d’un autre matériau inerte à haute température pour produire du trifluorure de chlore dans la méthode de fluoration directe.
Une autre méthode implique la réaction entre le fluorure d’hydrogène et le chlore gazeux. Dans cette méthode, les deux gaz passent sur un catalyseur, tel que de l’alumine activée ou du platine, à des températures élevées. La réaction entre les deux gaz produit du trifluorure de chlore et du chlorure d’hydrogène comme sous-produits.
Le tétrafluorure de soufre et le chlore gazeux réagissent en présence d’un catalyseur, tel que le fer ou le nickel, à des températures élevées pour synthétiser le trifluorure de chlore et produire du dioxyde de soufre comme sous-produit.
Un équipement spécialisé et une manipulation soigneuse sont nécessaires pour chacune de ces méthodes en raison de la nature dangereuse du trifluorure de chlore. La sécurité du personnel et de l’environnement doit être assurée pendant le processus de synthèse grâce à des mesures de sécurité appropriées telles que des combinaisons résistantes aux produits chimiques et des systèmes de ventilation.
Utilisations du trifluorure de chlore
Le trifluorure de chlore (ClF3) a plusieurs applications industrielles en raison de sa nature hautement réactive et de ses fortes propriétés oxydantes.
- ClF3 nettoie et grave les matériaux semi-conducteurs tels que le silicium et le germanium en éliminant les contaminants et impuretés indésirables de leurs surfaces.
- ClF3 convertit l’oxyde d’uranium en hexafluorure d’uranium pour la production de combustible nucléaire. L’hexafluorure d’uranium est enrichi pour être utilisé dans les réacteurs nucléaires.
- Le ClF3 augmente l’efficacité de la combustion et génère une plus grande poussée lorsqu’il est utilisé en combinaison avec d’autres agents oxydants tels que l’hydrazine ou l’hydrogène dans les propulseurs de fusée et les oxydants à haute énergie pour les systèmes de carburant.
- ClF3 blanchit les textiles et les produits en papier.
- ClF3 produit certains produits chimiques tels que le fluor gazeux et les fluorocarbures.
En raison de sa nature dangereuse, le trifluorure de chlore doit être manipulé avec une extrême prudence dans toutes ses applications, et uniquement par des professionnels formés disposant d’un équipement et de protocoles de sécurité appropriés.
Des questions:
Q : Le trifluorure de chlore est-il polaire ou non polaire ?
R : Le trifluorure de chlore est une molécule polaire en raison de la différence d’électronégativité entre les atomes de chlore et de fluor.
Q : Comment éteindre le trifluorure de chlore ?
R : Le trifluorure de chlore peut être éteint à l’aide de sable sec, de graphite ou de chlorure de sodium. L’eau ne doit jamais être utilisée pour éteindre un incendie de trifluorure de chlore, car elle peut réagir violemment et libérer des gaz toxiques.
Q : Structure de Lewis du trifluorure de chlore ?
R : La structure de Lewis de ClF3 est constituée d’un atome de chlore central entouré de trois atomes de fluor. L’atome de chlore est lié à chacun des trois atomes de fluor par une simple liaison, et il y a une seule paire d’électrons sur l’atome de chlore.
Q : Quelle est la charge formelle de l’atome de chlore dans la molécule de trifluorure de chlore ?
R : La charge formelle de l’atome de chlore dans le trifluorure de chlore est nulle. L’atome de chlore possède sept électrons de valence et est lié à trois atomes de fluor, qui ont une électronégativité supérieure à celle du chlore. La paire libre d’électrons sur l’atome de chlore n’est impliquée dans aucune liaison et n’est donc pas prise en compte lors de la détermination de la charge formelle.
Q : Incendie de trifluorure de chlore ?
R : Le trifluorure de chlore est une substance hautement réactive et inflammable qui peut s’enflammer spontanément au contact de matières organiques ou même de l’air. Dans le cas d’un incendie de trifluorure de chlore, du sable sec, du graphite ou du chlorure de sodium doit être utilisé pour éteindre l’incendie, et de l’eau ne doit jamais être utilisée car elle peut provoquer une réaction violente. L’évacuation de la zone et la nécessité de consulter immédiatement un médecin en cas d’exposition sont également cruciales en cas d’incendie de trifluorure de chlore.
