Le chlorure mercurique est un composé toxique de formule HgCl2. C’est un solide cristallin blanc utilisé dans les laboratoires comme réactif et désinfectant, mais une manipulation appropriée est essentielle.
| Nom UICPA | Chlorure de mercure (II) |
| Formule moléculaire | HgCl2 |
| Numero CAS | 7487-94-7 |
| Synonymes | Dichlorure de mercure, dichlorure mercurique, bichlorure de mercure, dichlorure de mercure (II) |
| InChI | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Propriétés du chlorure mercurique
Formule de chlorure mercurique
La formule du dichlorure mercurique est HgCl2. Il se compose d’un atome de mercure (Hg) et de deux atomes de chlore (Cl). Ce composé est également connu sous le nom de chlorure de mercure (II), symbolisant l’état d’oxydation +2 du mercure.
Chlorure Mercurique Masse molaire
La masse molaire du dichlorure mercurique est d’environ 271,52 g/mol. Il est calculé en additionnant les masses atomiques d’un atome de mercure (200,59 g/mol) et de deux atomes de chlore (35,45 g/mol chacun).
Point d’ébullition du chlorure mercurique
Le dichlorure mercurique a un point d’ébullition d’environ 302 °C (575,6 °F). A cette température, le dichlorure mercurique solide se transforme à l’état de vapeur.
Point de fusion du chlorure mercurique
Le point de fusion du dichlorure mercurique est d’environ -71 °C (-95,8 °F). A cette température, le dichlorure mercurique solide se transforme en liquide.
Densité du chlorure mercurique g/mL
La densité du dichlorure mercurique est d’environ 5,4 g/mL. Cette densité élevée en fait une substance relativement lourde.
Chlorure Mercurique Poids moléculaire
Le poids moléculaire du dichlorure mercurique est d’environ 271,52 g/mol. Il indique la masse d’une mole du composé et correspond à la somme de ses poids atomiques.
Structure du chlorure mercurique
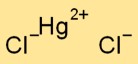
Le dichlorure mercurique a une structure cristalline. Il se compose d’ions mercure chargés positivement (Hg2+) et d’ions chlorure chargés négativement (Cl-), maintenus ensemble par des liaisons ioniques. L’agencement forme un motif en forme de treillis.
Solubilité du chlorure mercurique
Le dichlorure mercurique présente une solubilité limitée dans l’eau. Environ 7,7 grammes de dichlorure mercurique peuvent se dissoudre dans 100 ml d’eau à température ambiante (20 °C). Sa solubilité augmente avec des températures plus élevées.
Le dichlorure mercurique est une substance hautement toxique et doit être manipulé avec une extrême prudence. Il a été largement utilisé dans diverses applications, notamment comme réactif dans les laboratoires chimiques, comme désinfectant et dans les processus de galvanoplastie. En raison de sa toxicité, il est essentiel de suivre les protocoles de sécurité appropriés lorsque vous travaillez avec ce composé.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 5,4 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 271,52 g/mole |
| Densité | 5,4 g/ml |
| Point de fusion | -71 °C (-95,8 °F) |
| Point d’ébullition | 302 °C (575,6 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Limité |
| Solubilité | Soluble dans les solvants organiques tels que l’alcool, l’éther |
| Pression de vapeur | Négligeable |
| Densité de vapeur | 8,23 (air = 1) |
| pKa | N’est pas applicable |
| pH | Acide (dans l’eau) |
Sécurité et dangers du chlorure mercurique
Le dichlorure mercurique présente des risques importants pour la sécurité en raison de son extrême toxicité. Le contact direct avec la peau ou l’inhalation de ses vapeurs peut entraîner de graves problèmes de santé. Il est essentiel de le manipuler avec le plus grand soin, en utilisant un équipement de protection approprié comme des gants et un respirateur. Travaillez toujours dans un endroit bien ventilé pour minimiser l’exposition. Conservez-le dans des récipients hermétiquement fermés, à l’écart des substances incompatibles. En cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin. Des méthodes d’élimination appropriées doivent être suivies pour éviter la contamination de l’environnement. Dans l’ensemble, le strict respect des protocoles de sécurité est crucial lorsqu’il s’agit de dichlorure mercurique.
| Symboles de danger | Crâne et os croisés, corrosif |
| Description de la sécurité | Très toxique et corrosif. Utiliser avec une extrême prudence. Eviter le contact direct et l’inhalation des fumées. |
| Numéros d’identification de l’ONU | UN1624 (Composés du mercure, nsa) |
| Code SH | 2852.10.10 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II (Intermédiaire) |
| Toxicité | Extrêmement toxique pour les humains et les animaux. Manipulez avec soin et suivez des protocoles de sécurité stricts. |
Méthodes de synthèse du chlorure mercurique
Il existe différentes méthodes de synthèse du dichlorure mercurique.
Une approche courante implique la réaction du mercure métallique avec l’acide chlorhydrique . Dans un environnement contrôlé, ajoutez du mercure à l’acide pour produire du dichlorure de mercure et libérer de l’hydrogène gazeux. L’équation chimique de cette réaction est :
Hg + 2HCl -> HgCl2 + H2
Une autre méthode utilise la réaction entre l’oxyde de mercure (HgO) et l’acide chlorhydrique . Combinez l’oxyde de mercure avec l’acide pour former du dichlorure mercurique et de l’eau :
HgO + 2HCl -> HgCl2 + H2O
De plus, on peut produire du dichlorure mercurique en faisant réagir du mercure avec du chlore gazeux :
Hg + Cl2 -> HgCl2
N’oubliez pas d’effectuer la synthèse du dichlorure mercurique uniquement sous une hotte bien ventilée ou dans des conditions contrôlées en raison de sa nature toxique et corrosive. Une manipulation soigneuse et le respect des consignes de sécurité sont essentiels pour éviter toute exposition nocive pendant le processus de synthèse.
Utilisations du chlorure mercurique
Le dichlorure mercurique, également connu sous le nom de chlorure de mercure (II), a trouvé diverses applications dans différents domaines en raison de ses propriétés uniques. Voici quelques-unes de ses principales utilisations :
Réactif de laboratoire : Le dichlorure mercurique sert de réactif important dans les laboratoires chimiques pour diverses procédures analytiques et synthétiques.
Désinfectant : Ses fortes propriétés antimicrobiennes le rendent précieux comme désinfectant, notamment pour stériliser les équipements et les surfaces.
Médecine : Bien que limitée en raison de sa toxicité, elle a été utilisée en médecine traditionnelle pour certaines affections.
Photographie : Dans le passé, le chlorure mercurique jouait un rôle dans les débuts de la photographie en tant qu’agent fixateur pour le développement des photographies.
Galvanoplastie : Dans les processus de galvanoplastie, les individus utilisent le dichlorure de mercure comme électrolyte pour déposer des revêtements métalliques sur divers objets.
Préservation du bois : Tout au long de l’histoire, les gens l’ont utilisé pour traiter le bois, le protégeant ainsi de la pourriture et des parasites.
Industrie textile : les fabricants ont utilisé du chlorure mercurique pour éliminer la couleur des textiles pendant les processus de teinture.
Chimie analytique : les chimistes l’utilisent pour des tests et des réactions spécifiques en analyse chimique.
Synthèse organique de niche : elle trouve des applications dans des réactions de synthèse organique spécifiques.
Fongicide et algicide : Les agriculteurs l’utilisent activement comme fongicide et algicide pour contrôler la croissance des champignons et des algues en agriculture.
Des questions:
Q : Le HgCl2 est-il soluble ou insoluble dans l’eau ?
R : HgCl2 est légèrement soluble dans l’eau.
Q : Quels sont le cation et l’anion du composé HgCl2 ?
R : Le cation est Hg2+ (mercure) et l’anion est Cl- (chlorure).
Q : Le HgCl2 est-il ionique ou covalent ?
R : HgCl2 est un composé ionique.
Q : Comment fabriquer du chlorure mercurique dans Minecraft ?
R : Dans Minecraft, le dichlorure mercurique peut être synthétisé en combinant du mercure et du chlore dans une table de fabrication.
Q : À quoi sert le chlorure mercurique ?
R : Le dichlorure mercurique est utilisé dans les laboratoires comme réactif et désinfectant.
Q : Qui a inventé le chlorure mercurique ?
R : La découverte et les premières utilisations du dichlorure mercurique remontent à l’Antiquité, il n’a donc pas d’inventeur spécifique.
Q : Comment fabriquer du chlorure mercurique dans Minecraft Education Edition ?
R : Dans Minecraft Education Edition, le dichlorure mercurique peut être créé en combinant du mercure et du chlore dans une table de fabrication, tout comme dans la version Minecraft standard.
Q : Qu’est-ce que le chlorure mercurique ?
R : Le dichlorure mercurique est un composé toxique de formule chimique HgCl2.
Q : Le HgCl2 est-il un solide ?
R : Oui, HgCl2 est un solide à température ambiante.
Q : Quel est le nom correct de HgCl2 dans la dénomination ionique ?
R : Le nom correct pour HgCl2 dans la dénomination ionique est le dichlorure de mercure (II).
Q : Quel est le nom de HgCl2 ?
R : Le nom de HgCl2 est dichlorure mercurique.
Q : 2 HgCl2(aq) + C2O4^(2-)(aq) → 2 Cl^-(aq) + 2 CO2(g) + Hg2Cl2(s), quelle est la loi de vitesse de la réaction ?
A : Loi de taux : Taux = k[HgCl2]^2[C2O4^2-] (deuxième ordre par rapport à HgCl2 et premier ordre par rapport à C2O4^2-).
