Le chlorure d’or (AuCl3) est un composé formé en combinant de l’or avec du chlore. Il est utilisé dans diverses applications, notamment le placage à l’or et comme catalyseur dans des réactions chimiques.
| Nom UICPA | Chlorure d’or(III) |
| Formule moléculaire | AuCl3 |
| Numero CAS | 13453-07-1 |
| Synonymes | Chlorure aurique, Trichlorogold, Trichlorure d’or |
| InChI | InChI=1S/3ClH.Au/h3*1H;/q;;;+3/p-3 |
Propriétés du chlorure d’or
Formule de chlorure d’or
La formule du trichlorure d’or est AuCl3. C’est un composé chimique composé d’un atome d’or (Au) et de trois atomes de chlore (Cl). Cette formule représente la stœchiométrie des éléments présents dans le trichlorure d’or.
Chlorure D’or Masse molaire
La masse molaire du trichlorure d’or est calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour le trichlorure d’or (AuCl3), la masse molaire est d’environ 303,33 g/mol. Il est utile pour déterminer la quantité de substance dans un échantillon donné.
Point d’ébullition du chlorure d’or
Le trichlorure d’or a un point d’ébullition d’environ 254 °C (degrés Celsius). À cette température, le composé passe de l’état liquide à l’état gazeux. Le point d’ébullition indique la température à laquelle la pression de vapeur du liquide est égale à la pression atmosphérique.
Point de fusion du chlorure d’or
Le point de fusion du trichlorure d’or est d’environ 254 °C (degrés Celsius). C’est la température à laquelle la forme solide du composé se transforme en liquide. Comprendre le point de fusion est essentiel dans divers processus industriels.
Densité du chlorure d’or g/mL
La densité du trichlorure d’or est d’environ 4,7 g/mL (grammes par millilitre). La densité est la mesure de la masse par unité de volume d’une substance. La densité relativement élevée du trichlorure d’or le rend plus lourd que l’eau.
Chlorure d’or Poids moléculaire
Le poids moléculaire du trichlorure d’or, également connu sous le nom de masse molaire, est d’environ 303,33 g/mol (grammes par mole). C’est la somme des poids atomiques de tous les atomes du composé. Le poids moléculaire est crucial dans les calculs chimiques.
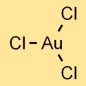
Structure du chlorure d’or
Le trichlorure d’or (AuCl3) a une structure moléculaire constituée d’un atome d’or lié à trois atomes de chlore. L’arrangement forme une forme planaire trigonale, avec l’atome d’or au centre et les atomes de chlore qui l’entourent.
Solubilité du chlorure d’or
Le trichlorure d’or présente une solubilité limitée dans l’eau. Il se dissout mieux dans certains solvants organiques, comme l’éthanol et le chloroforme. La solubilité du trichlorure d’or est influencée par des facteurs tels que la température et la nature du solvant.
| Apparence | Solide jaunâtre |
| Gravité spécifique | ~4,7 g/mL |
| Couleur | Jaune |
| Odeur | Inodore |
| Masse molaire | ~303,33 g/mole |
| Densité | ~4,7 g/mL |
| Point de fusion | ~254 °C |
| Point d’ébullition | ~254 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Solubilité limitée |
| Solubilité | Soluble dans certains solvants organiques tels que l’éthanol et le chloroforme |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Neutre (pH 7) |
Sécurité et dangers du chlorure d’or
Le trichlorure d’or présente des risques potentiels pour la sécurité et nécessite une manipulation prudente. Il est essentiel de porter un équipement de protection approprié, tel que des gants et des lunettes de sécurité, pour éviter tout contact avec la peau et toute irritation des yeux. L’inhalation de ses poussières ou de ses vapeurs doit être évitée en raison de problèmes respiratoires potentiels. De plus, l’exposition à des températures élevées peut entraîner la libération de chlore gazeux toxique. Le composé est également incompatible avec les agents réducteurs puissants, ce qui peut entraîner des réactions dangereuses. Des mesures appropriées de stockage, d’étiquetage et de confinement sont nécessaires pour prévenir les accidents. Comprendre ces dangers et ces précautions de sécurité est crucial lorsque l’on travaille avec du trichlorure d’or en laboratoire ou en milieu industriel.
| Symboles de danger | Danger |
| Description de la sécurité | Manipuler avec soin. Évitez tout contact avec la peau et les yeux. Ne pas inhaler les poussières ou les vapeurs. Tenir à l’écart des agents réducteurs puissants. |
| Numéros d’identification de l’ONU | Pas disponible |
| Code SH | 2843.29 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II |
| Toxicité | Très toxique en cas d’ingestion ou d’inhalation. Peut provoquer une irritation de la peau et des yeux. |
Méthodes de synthèse du chlorure d’or
Plusieurs méthodes permettent la synthèse du trichlorure d’or.
Une approche courante consiste à dissoudre l’or ou l’oxyde d’or dans de l’acide chlorhydrique (HCl) . La réaction produit du trichlorure d’or et de l’eau. Une autre méthode consiste à faire réagir l’or avec du chlore gazeux, formant directement du trichlorure d’or. Alternativement, le chlore gazeux peut réagir avec l’or métallique en présence d’un catalyseur tel que le chlorure de fer, produisant du trichlorure d’or et du chlorure de fer comme sous-produits.
Une autre voie de synthèse consiste à faire réagir l’or métallique avec de l’eau régale, un mélange d’acide nitrique concentré (HNO3) et d’acide chlorhydrique . Les puissantes propriétés oxydantes de l’Aqua regia convertissent l’or en trichlorure d’or, qui peut être isolé par évaporation. Le trichlorure d’or se forme lorsque l’acide chlorhydrique réagit avec l’oxyde d’or (III) (Au2O3), produisant du trichlorure d’or et de l’eau.
Divers agents réducteurs, comme le chlorure d’étain (II) (SnCl2) ou le dioxyde de soufre (SO2), peuvent réduire activement le chlorure d’or (V) (AuCl5) pour synthétiser le trichlorure d’or. La réaction produit du trichlorure d’or et le chlorure de l’agent réducteur correspondant.
Chaque méthode a ses avantages et son applicabilité, en fonction des matières premières disponibles et de la pureté souhaitée du trichlorure d’or. Un examen attentif des conditions de réaction et des mesures de sécurité est crucial pendant le processus de synthèse.
Utilisations du chlorure d’or
Le trichlorure d’or trouve diverses applications en raison de ses propriétés uniques :
- Placage d’or : Le trichlorure d’or sert de source d’ions d’or pour les processus de galvanoplastie, permettant le dépôt d’une fine couche d’or sur les surfaces. Cela améliore la conductivité et offre une finition attrayante et résistante à la corrosion.
- Catalyseur : Le trichlorure d’or agit comme catalyseur dans diverses réactions chimiques, notamment en synthèse organique. Sa capacité à activer certaines liaisons le rend précieux pour favoriser des réactions spécifiques.
- Médecine : Les chercheurs ont exploré des composés à base de trichlorure d’or pour des applications thérapeutiques potentielles dans le traitement de l’arthrite et d’autres maladies inflammatoires.
- Photographie : En photographie, le trichlorure d’or sert de toner, conférant des couleurs violettes et brunes aux tirages en noir et blanc.
- Verre et céramique : L’industrie du verre utilise du trichlorure d’or pour produire du verre rubis, lui donnant une couleur rouge, et la céramique bénéficie de son utilisation pour améliorer la coloration.
- Nanotechnologie : Le trichlorure d’or joue un rôle crucial dans la nanotechnologie en facilitant la synthèse de nanoparticules d’or, qui ont des applications en électronique, en catalyse et en imagerie médicale.
- Agent antibactérien : Les nanoparticules de trichlorure d’or se sont révélées prometteuses en tant qu’agents antibactériens, inhibant efficacement la croissance de certaines bactéries.
- Conservation de l’art : dans la restauration d’œuvres d’art, les experts utilisent le trichlorure d’or pour dorer et recréer des pigments historiques.
- Réactif de laboratoire : Les scientifiques l’utilisent comme réactif de laboratoire pour diverses analyses chimiques et à des fins de recherche.
- Encres métalliques : les fabricants utilisent des encres à base de trichlorure d’or à des fins d’impression, insufflant une touche de luxe à des produits comme la papeterie et les emballages.
En raison de sa polyvalence et de ses propriétés uniques, le trichlorure d’or continue d’être pertinent dans diverses industries, jouant un rôle important dans la technologie, l’art, la médecine et la science des matériaux.
Des questions:
Q : Quel produit chimique puis-je utiliser pour précipiter l’or du chlorure d’or ?
R : Le métabisulfite de sodium (Na2S2O5) peut être utilisé comme agent réducteur pour précipiter l’or à partir des solutions de trichlorure d’or.
Q : L’or monoatomique est-il contenu dans du chlorure d’or ?
R : Non, l’or monoatomique n’est pas du trichlorure d’or ; c’est une forme distincte d’or constituée d’atomes individuels, et non dans un état composé.
Q : Quelle est la masse molaire du chlorure d’or III ?
R : La masse molaire du trichlorure d’or III (AuCl3) est d’environ 303,33 g/mol.
Q : Qu’est-ce que le chlorure d’or ?
R : Le trichlorure d’or (AuCl3) est un composé chimique formé en combinant de l’or avec du chlore, utilisé dans diverses applications telles que le placage à l’or et la catalyse.
Q : Comment fabriquer du chlorure stanneux pour tester l’or ?
R : Le chlorure stanneux (SnCl2) peut être préparé en dissolvant de l’étain métallique dans de l’acide chlorhydrique (HCl), suivi d’une réduction.
Q : Quelle est la masse molaire d’AuCl3 ?
R : La masse molaire d’AuCl3 (trichlorure d’or III) est d’environ 303,33 g/mol.
Q : Quel est le pourcentage d’or dans AuCl3 ?
R : Le pourcentage d’or dans AuCl3 est d’environ 42,49 %.
Q : Combien de moles de H2O y a-t-il dans 3,4 g d’AuCl3 · 2 H2O ?
R : Il y a 0,0349 mole de H2O dans 3,4 g d’AuCl3 · 2 H2O.
Q : AuCl3 est-il soluble dans l’eau ?
R : Oui, AuCl3 (trichlorure d’or III) est dans une certaine mesure soluble dans l’eau.
Q : Combien de grammes d’or peut-on récupérer à partir de 35 g d’AuCl3 ?
R : Environ 14,87 grammes d’or peuvent être récupérés à partir de 35 g d’AuCl3.
Q : Quelle est la solubilité molaire de AuCl3 ? Ksp = 3,2 × 10−25
R : La solubilité molaire de AuCl3, étant donné Ksp = 3,2 × 10−25, est d’environ 1,8 × 10^-9 mol/L.
