Le chlorure de zinc (ZnCl2) est un composé cristallin blanc. Il est utilisé dans diverses applications industrielles telles que les flux de brasage, la synthèse chimique et la galvanisation. Il est très soluble dans l’eau.
| Nom UICPA | Chlorure de zinc |
| Formule moléculaire | ZnCl2 |
| Numero CAS | 7646-85-7 |
| Synonymes | Beurre de zinc; Dichlorure de zinc; Chlorure de zinc (II); Beurre de zinc; CI77043 |
| InChI | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
Propriétés du chlorure de zinc
Formule de chlorure de zinc
La formule chimique du dichlorure de zinc est ZnCl2. Il est composé d’un atome de zinc (Zn) et de deux atomes de chlore (Cl). Ce composé ionique forme un solide cristallin blanc avec une structure distincte.
Chlorure De Zinc Masse molaire
La masse molaire du dichlorure de zinc est d’environ 136,29 grammes par mole (g/mol). Il est dérivé de la somme des masses atomiques d’un atome de zinc et de deux atomes de chlore.
Point d’ébullition du chlorure de zinc
Le dichlorure de zinc a un point d’ébullition relativement élevé d’environ 732 degrés Celsius (C) ou 1 350 degrés Fahrenheit (F). À cette température, il passe de l’état liquide à l’état gazeux.
Point de fusion du chlorure de zinc
Le point de fusion du dichlorure de zinc est d’environ 290 degrés Celsius (C) ou 554 degrés Fahrenheit (F). A cette température, le dichlorure de zinc solide passe à l’état liquide.
Densité du chlorure de zinc g/mL
La densité du dichlorure de zinc est d’environ 2,91 grammes par millilitre (g/mL) à température ambiante. Cette propriété décrit sa masse par unité de volume.
Chlorure De Zinc Poids moléculaire
Le poids moléculaire du dichlorure de zinc, calculé à partir de sa formule chimique, est d’environ 136,29 g/mol. Cette valeur représente la somme des poids atomiques de ses atomes constitutifs.
Structure du chlorure de zinc
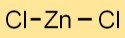
Le dichlorure de zinc présente une structure de réseau cristallin avec des cations Zn2+ et des Clanions maintenus ensemble par des liaisons ioniques. L’agencement forme un réseau tridimensionnel stable et ordonné.
Solubilité du chlorure de zinc
Le dichlorure de zinc est très soluble dans l’eau, ce qui signifie qu’il se dissout facilement en présence de molécules d’eau. Cette propriété contribue à son utilisation généralisée dans diverses applications industrielles et procédés chimiques.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,91 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 136,29 g/mole |
| Densité | 2,91 g/cm³ |
| Point de fusion | 290°C (554°F) |
| Point d’ébullition | 732°C (1350°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble dans l’eau |
| Solubilité | Soluble dans les solvants organiques tels que l’alcool et l’acétone |
| Pression de vapeur | 1 mmHg à 359°C |
| Densité de vapeur | 5,4 (air = 1) |
| pKa | -1,9 |
| pH | ~5 (solution 0,1 M dans l’eau) |
Sécurité et dangers du chlorure de zinc
Le dichlorure de zinc présente certains risques pour la sécurité qui nécessitent une manipulation prudente. Le contact direct avec la peau ou les yeux peut provoquer des irritations et des brûlures. L’inhalation de ses vapeurs peut irriter le système respiratoire. Il est essentiel de porter des équipements de protection tels que des gants et des lunettes lors de la manipulation du composé. De plus, il doit être stocké dans un endroit bien ventilé, à l’écart des substances incompatibles. En cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin. Évitez de le rejeter dans l’environnement, car il peut être nocif pour la vie aquatique. En suivant les mesures et directives de sécurité appropriées, les risques associés au dichlorure de zinc peuvent être minimisés efficacement.
| Symboles de danger | Corrosif (C); Nocif (Xn) |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Portez des gants et des lunettes de protection. En cas de contact ou d’ingestion, consulter un médecin. Ne pas rejeter dans l’environnement. Tenir à l’écart des substances incompatibles. |
| Numéros d’identification de l’ONU | No ONU 2331 (Dichlorure de zinc anhydre) ; No ONU 2332 (Dichlorure de zinc, solution) |
| Code SH | 28273990 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II (Danger moyen) |
| Toxicité | Nocif en cas d’ingestion ou d’inhalation. |
Méthodes de synthèse du chlorure de zinc
Diverses méthodes permettent la synthèse du dichlorure de zinc.
Une approche courante implique la réaction de l’oxyde de zinc (ZnO) avec l’acide chlorhydrique (HCl) . Dans cette méthode, un chimiste ajoute lentement du ZnO à une solution de HCl tout en remuant continuellement. La réaction produit du dichlorure de zinc et de l’eau comme sous-produits. Une autre méthode consiste à combiner directement du zinc métallique avec du chlore gazeux (Cl2). Cette réaction nécessite un contrôle minutieux de la température et de la pression pour garantir un résultat réussi.
Un procédé alternatif consiste à dissoudre le zinc métallique dans une solution de HCl, ce qui entraîne la formation de dichlorure de zinc et d’hydrogène gazeux (H2). Le traitement du HCl avec du carbonate de zinc (ZnCO3) ou de l’hydroxyde de zinc (Zn(OH)2) produit du dichlorure de zinc, de l’eau et du dioxyde de carbone (CO2) comme sous-produits.
Le sulfate de zinc (ZnSO4) et le chlorure de baryum (BaCl2) subissent une double réaction de décomposition pour donner du dichlorure de zinc ainsi que la formation de sulfate de baryum (BaSO4). En mélangeant ces deux composés, le dichlorure de zinc précipite, tandis que le sulfate de baryum (BaSO4) reste dans la solution.
Chacune de ces méthodes fournit une voie de synthèse du dichlorure de zinc et le choix de la méthode dépend de facteurs tels que la disponibilité des réactifs, les conditions de réaction et la pureté souhaitée du produit final.
Utilisations du chlorure de zinc
Le dichlorure de zinc trouve un large éventail d’applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations importantes du dichlorure de zinc :
- Galvanisation : Le dichlorure de zinc joue un rôle essentiel dans le processus de galvanisation pour prévenir la corrosion des métaux comme l’acier et le fer. Il forme un revêtement de zinc protecteur, améliorant leur longévité et leur durabilité.
- Flux de soudure : Dans les opérations de brasage, le dichlorure de zinc agit comme un flux pour éliminer les oxydes métalliques de la surface des métaux, assurant une meilleure adhérence et une liaison solide entre la soudure et le métal.
- Synthèse chimique : Il sert de catalyseur ou de réactif dans de nombreuses réactions chimiques, telles que l’acylation et la déshydratation de Friedel-Crafts.
- Préservation du bois : les applications de préservation du bois utilisent du dichlorure de zinc pour protéger le bois de la pourriture fongique et des insectes, prolongeant ainsi sa durée de vie.
- Traitement des textiles : Dans l’industrie textile, il facilite la production de tissus en coton mercerisé, conférant des propriétés souhaitables telles qu’un lustre accru et une résistance améliorée.
- Électrolyte de batterie : Le dichlorure de zinc agit comme un électrolyte dans certaines batteries, comme la batterie zinc-carbone, aidant à faciliter la circulation des ions entre les électrodes.
- Déodorant et antisudorifique : C’est un ingrédient courant dans les antisudorifiques en raison de ses propriétés astringentes qui aident à réduire la production de sueur et à contrôler les odeurs corporelles.
- Produits pharmaceutiques : Le dichlorure de zinc trouve une application dans diverses formulations pharmaceutiques, en particulier dans les bains de bouche, les pastilles pour la gorge et les solutions antiseptiques topiques.
- Industrie de la teinture : L’industrie de la teinture utilise du dichlorure de zinc comme mordant dans le processus de teinture pour améliorer la solidité des couleurs des tissus avec des colorants.
- Formulations adhésives : Les fabricants incorporent du dichlorure de zinc dans les formulations adhésives pour améliorer les propriétés de liaison des colles et des ciments.
La polyvalence du dichlorure de zinc en fait un composé essentiel dans de nombreux processus industriels et produits du quotidien, contribuant ainsi au progrès de plusieurs industries clés.
Des questions:
Q : Le ZnCl2 est-il soluble dans l’eau ?
R : Oui, le ZnCl2 est hautement soluble dans l’eau.
Q : Quelle est l’équation ionique nette de la réaction de ZnCl2 avec NaOH ?
R : L’équation ionique nette est Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s).
Q : Le ZnCl2 est-il soluble ?
R : Oui, le ZnCl2 est soluble dans l’eau.
Q : Le ZnCl2 est-il ionique ou moléculaire ?
R : ZnCl2 est un composé ionique.
Q : Quel type de liaison se produit dans le chlorure de zinc(II), ZnCl2 ?
R : La liaison ionique se produit dans ZnCl2.
Q : Quel changement pourrait diminuer le taux de production de ZnCl2 ?
R : Abaisser la température de la réaction pourrait diminuer le taux de production de ZnCl2.
Q : Le ZnCl2 est-il solide ?
R : Oui, le ZnCl2 est un solide à température ambiante.
Q : Le ZnCl2 est-il un sel ?
R : Oui, le ZnCl2 est considéré comme un sel.
Q : Comment obtiendrez-vous du chlorure de zinc à partir du zinc ?
R : La réaction du zinc avec l’acide chlorhydrique produira du chlorure de zinc.
Q : Quelle est la formule du chlorure de zinc ?
R : La formule du chlorure de zinc est ZnCl2.
Q : Les piles au chlorure de zinc sont-elles nocives pour la terre ?
R : Oui, les piles au chlorure de zinc peuvent être nocives pour l’environnement si elles ne sont pas correctement éliminées.
Q : Quelle est la masse molaire du chlorure de zinc ?
R : La masse molaire du chlorure de zinc est d’environ 136,29 g/mol.
