Le chlorure de potassium (KCl) est un composé contenant du potassium et du chlore. Il est utilisé comme engrais, additif alimentaire et traitement médical pour les faibles niveaux de potassium. Il peut également être utilisé dans des injections mortelles.
| Nom UICPA | Chlorure de potassium |
| Formule moléculaire | KCl |
| Numero CAS | 7447-40-7 |
| Synonymes | KCl, Kalium Chloratum, Muriate de Potasse, Sylvite, Chloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| InChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Formule de chlorure de potassium
La formule chimique du chlorure de potassium est KCl. C’est un composé binaire composé d’un atome de potassium et d’un atome de chlore. La formule du chlorure de potassium est importante pour comprendre ses propriétés chimiques et pour effectuer les calculs liés à son utilisation dans diverses applications.
Masse molaire du chlorure de potassium
La masse molaire du KCl est de 74,55 g/mol. C’est un solide cristallin blanc au goût salé et hautement soluble dans l’eau. Le KCl est un composé composé d’un atome de potassium et d’un atome de chlore.
Point d’ébullition du chlorure de potassium
Le point d’ébullition du KCl est de 1 420 °C (2 588 °F). C’est un composé à point de fusion élevé qui nécessite une énergie importante pour atteindre son point d’ébullition. Le point d’ébullition élevé du KCl le rend utile dans les applications à haute température, comme dans la production de céramique et de verre.
Point de fusion du KCl
Le point de fusion du KCl est de 770°C (1 418°F). Il s’agit d’un composé à point de fusion relativement élevé qui nécessite une chaleur importante pour fondre. Le KCl est utilisé dans la production d’engrais et son point de fusion élevé contribue à garantir sa stabilité à des températures élevées.
Densité KCl g/ml
La densité du KCl est de 1,98 g/cm³. C’est un composé relativement dense, ce qui signifie qu’une petite quantité contient un grand nombre de particules. La haute densité du KCl le rend utile dans certaines applications industrielles, comme dans la production de fluides de forage.
Poids moléculaire du KCl
Le poids moléculaire du KCl est de 74,55 g/mol. C’est un composé relativement léger, ce qui signifie qu’il contient un petit nombre de particules. Le faible poids moléculaire du KCl le rend facile à transporter et à manipuler en milieu industriel.
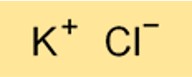
Structure KCl
La structure du KCl est un réseau cristallin ionique. Il consiste en une alternance d’ions potassium et chlore disposés selon un motif répétitif. La nature ionique de la structure signifie que le KCl est un bon conducteur d’électricité lorsqu’il est dissous dans l’eau.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,98 g/cm³ |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 74,55 g/mole |
| Densité | 1,98 g/cm³ |
| Point de fusion | 770°C (1 418°F) |
| Point d’ébullition | 1 420 °C (2 588 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 34,7 g/100 ml (0 °C) |
| Solubilité | Soluble dans l’eau, le glycérol et le formamide ; légèrement soluble dans l’éthanol |
| La pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | -1,8 (acide conjugué) |
| pH | 7 (solution à 10%) |
Sécurité et dangers du chlorure de potassium
Le chlorure de potassium (KCl) présente des dangers potentiels et des problèmes de sécurité qui doivent être pris en compte lors de sa manipulation ou de son utilisation. Cela peut provoquer une irritation de la peau et des yeux, et une exposition prolongée peut entraîner des brûlures chimiques. L’inhalation de poussière de KCl peut provoquer une irritation respiratoire et de la toux. De plus, l’ingestion de grandes quantités de KCl peut entraîner des déséquilibres électrolytiques et des arythmies cardiaques. Il est important de porter un équipement de protection individuelle approprié, tel que des gants et des lunettes de protection, et de manipuler le KCl dans un endroit bien ventilé. En cas de contact avec la peau ou les yeux, il est important de rincer abondamment la zone concernée et de consulter un médecin si nécessaire.
| Symboles de danger | Aucun |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Nocif en cas d’ingestion. |
| ID ONU | UN1480 |
| Code SH | 310420 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | DL50 (rat, orale) : 2 500 mg/kg |
Méthodes de synthèse du chlorure de potassium
Plusieurs méthodes peuvent synthétiser le chlorure de potassium (KCl), notamment :
- Solubilisation et cristallisation : Cette méthode consiste à dissoudre le KCl dans l’eau, puis à laisser la solution s’évaporer, laissant derrière elle des cristaux solides de KCl.
- Échange d’ions : Pour produire du KCl, on peut échanger des ions dans une solution d’un autre sel, comme le chlorure de sodium, avec des ions potassium. Les industries utilisent couramment cette méthode dans la production d’engrais KCl.
- Électrolyse : L’électrolyse d’une solution de KCl produit du potassium élémentaire et du chlore gazeux, qui se combinent pour former du KCl.
- Réaction de l’hydroxyde de potassium avec l’acide chlorhydrique : L’hydroxyde de potassium peut réagir avec l’acide chlorhydrique pour produire du KCl et de l’eau.
- Réaction du carbonate de potassium avec l’acide chlorhydrique : Le carbonate de potassium peut réagir avec l’acide chlorhydrique pour produire du KCl, du dioxyde de carbone et de l’eau.
Chaque méthode a ses propres avantages et inconvénients, et le choix de la méthode peut dépendre de facteurs tels que la pureté requise du produit, l’échelle de production et le coût des matières premières et de l’équipement.
Utilisations du chlorure de potassium
Le chlorure de potassium a un large éventail d’utilisations, notamment :
- Engrais : Utilisé comme engrais pour fournir les nutriments essentiels à la croissance des plantes.
- Additif alimentaire : Utilisé comme substitut du sel dans les aliments transformés pour réduire l’apport en sodium.
- Traitement de l’eau : ajouté aux systèmes de traitement de l’eau pour prévenir la corrosion et la formation de tartre.
- Applications médicales : Utilisé dans les liquides intraveineux et les solutions de réhydratation orale pour remplacer les électrolytes et traiter des affections telles que l’hypokaliémie.
- Applications industrielles : Utilisé dans la production de verre, de céramique et de savons, et comme matière première dans la production d’autres produits chimiques.
- Alimentation animale : Ajouté à l’alimentation animale pour fournir des nutriments essentiels.
- Agent de dégivrage : Utilisé comme agent de dégivrage pour faire fondre la glace et la neige sur les routes et les trottoirs.
- Forage pétrolier et gazier : Utilisé comme stabilisant d’argile dans les opérations de forage pétrolier et gazier.
- Réactif de laboratoire : utilisé comme réactif dans les expériences et analyses en laboratoire.
Des questions:
Q : Qu’est-ce que le chlorure de potassium ?
R : Le chlorure de potassium (KCl) est un sel cristallin blanc composé d’ions potassium et chlore. Il a de nombreuses applications dans des secteurs tels que l’agriculture, l’alimentation, la médecine et la fabrication de produits chimiques.
Q : À quoi sert le chlorure de potassium ?
R : Le chlorure de potassium est couramment utilisé comme engrais, additif alimentaire et dans des applications médicales pour traiter des affections telles que l’hypokaliémie. Il peut également être utilisé dans le traitement de l’eau, les procédés industriels, l’alimentation animale, le dégivrage, le forage pétrolier et gazier et les expériences en laboratoire.
Q : Le chlorure de potassium est-il sans danger ?
R : Le chlorure de potassium peut être nocif s’il est ingéré en grande quantité ou s’il entre en contact avec les yeux ou la peau. Il est important de suivre les directives et réglementations de sécurité appropriées lors de la manipulation ou de l’utilisation du chlorure de potassium.
Q : Le KCl est-il soluble dans l’eau ?
R : Oui, le KCl est hautement soluble dans l’eau. À température ambiante, un gramme de KCl peut se dissoudre dans 1,5 ml d’eau.
Q : Le KCl est-il ionique ou covalent ?
R : Le KCl est un composé ionique, car il est composé d’ions potassium chargés positivement et d’ions chlorure chargés négativement qui sont maintenus ensemble par des liaisons ioniques.
Q : Le KCl est-il un acide ou une base ?
R : Le chlorure de potassium est un composé neutre et n’est ni un acide ni une base.
Q : Le KCl est-il un électrolyte puissant ?
R : Oui, le KCl est un électrolyte puissant car il se dissocie complètement en ions potassium et chlorure lorsqu’il est dissous dans l’eau, permettant ainsi la conductivité électrique.
