Le chlorure de nickel (II), connu sous le nom de NiCl2, est un composé chimique de couleur jaune verdâtre. Il est couramment utilisé dans la galvanoplastie, les catalyseurs et comme précurseur dans la synthèse d’autres composés du nickel.
| Nom de l’UICPA | Chlorure de nickel(II) |
| Formule moléculaire | NiCl2 |
| Numero CAS | 7718-54-9 |
| Synonymes | Chlorure de nickel, dichlorure de nickel, dichloronickel, chlorure de nickel |
| InChI | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Propriétés du chlorure de nickel
Formule de chlorure de nickel
La formule du dichlorure de nickel est NiCl2. Cela indique que chaque molécule de dichlorure de nickel est constituée d’un atome de nickel lié à deux atomes de chlore. Cette formule chimique fournit des informations importantes sur la composition et le rapport des éléments présents dans le composé.
Chlorure De Nickel Masse molaire
La masse molaire du dichlorure de nickel, calculée en additionnant les masses atomiques de ses éléments constitutifs, est d’environ 129,6 grammes par mole. Cette valeur est utile pour déterminer la quantité de dichlorure de nickel présente dans un échantillon donné et pour divers calculs stœchiométriques.
Point d’ébullition du chlorure de nickel
Le dichlorure de nickel a un point d’ébullition d’environ 1 007 degrés Celsius (1 845 degrés Fahrenheit). A cette température, le composé subit une transition de phase de son état liquide à un état gazeux. Le point d’ébullition est une propriété physique importante qui aide à comprendre le comportement du dichlorure de nickel lorsqu’il est chauffé.
Point de fusion du chlorure de nickel
Le point de fusion du dichlorure de nickel est d’environ 1 002 degrés Celsius (1 836 degrés Fahrenheit). Il s’agit de la température à laquelle la forme solide du dichlorure de nickel passe à l’état liquide. Le point de fusion est important pour les applications impliquant la manipulation et le traitement du dichlorure de nickel.
Densité du chlorure de nickel g/mL
La densité du dichlorure de nickel est d’environ 3,55 grammes par millilitre. La densité est une mesure de la masse par unité de volume d’une substance et fournit des informations sur la compacité du matériau. La densité du dichlorure de nickel permet de déterminer son comportement dans diverses applications et dans différents états physiques.
Chlorure De Nickel Poids moléculaire
Le poids moléculaire du dichlorure de nickel est d’environ 129,6 grammes par mole. Il est calculé en additionnant les masses atomiques de nickel et de chlore dans le composé. Le poids moléculaire est essentiel pour comprendre les relations entre la masse, les taupes et le nombre de particules dans les réactions chimiques.
Structure du chlorure de nickel
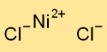
Le dichlorure de nickel adopte une structure de réseau cristallin sous sa forme solide. Il se compose de cations nickel (Ni2+) et d’anions chlorure (Cl-) disposés en alternance. Cet agencement forme un réseau tridimensionnel contribuant à la stabilité et aux propriétés physiques du dichlorure de nickel.
Solubilité du chlorure de nickel
Le dichlorure de nickel présente une solubilité modérée dans l’eau. Il peut se dissoudre pour former une solution jaune verdâtre. La solubilité du dichlorure de nickel est influencée par des facteurs tels que la température et la présence d’autres substances. Comprendre sa solubilité est important dans divers processus industriels et applications chimiques impliquant le dichlorure de nickel.
| Apparence | Solide jaune verdâtre |
| Gravité spécifique | 3,55 g/ml |
| Couleur | Jaune verdâtre |
| Odeur | Inodore |
| Masse molaire | 129,6 g/mole |
| Densité | 3,55 g/ml |
| Point de fusion | 1 002 °C (1 836 °F) |
| Point d’ébullition | 1 007 °C (1 845 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Modéré |
| Solubilité | Soluble dans les solvants organiques (éthanol, acétone) et les acides |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Acide (environ 4) |
Sécurité et dangers du chlorure de nickel
Le dichlorure de nickel présente certains risques pour la sécurité qui doivent être pris en compte. Il est important de manipuler ce composé avec précaution pour éviter les risques potentiels. Le dichlorure de nickel peut provoquer une irritation et une sensibilisation cutanées, c’est pourquoi des gants et des vêtements de protection doivent être portés lors de sa manipulation. L’inhalation de poussières ou de vapeurs de dichlorure de nickel doit être évitée car cela peut entraîner une irritation respiratoire. L’ingestion de dichlorure de nickel peut être nocive et doit être évitée. De plus, le dichlorure de nickel est toxique pour la vie aquatique et peut causer des dommages environnementaux s’il est rejeté dans les plans d’eau. Des procédures appropriées de stockage, de manipulation et d’élimination doivent être suivies pour minimiser les risques associés au dichlorure de nickel.
| Symboles de danger | Corrosif, nocif, risque environnemental |
| Description de la sécurité | – Porter des gants et des vêtements de protection – Éviter l’inhalation de poussières ou de vapeurs – Prévenir l’ingestion – Stocker, manipuler et éliminer correctement |
| Identifiants des Nations Unies | UN3288 |
| Code SH | 2827.39.80 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | III |
| Toxicité | Nocif en cas d’ingestion, provoque une irritation de la peau et des yeux |
Méthodes de synthèse du chlorure de nickel
Il existe plusieurs méthodes de synthèse du dichlorure de nickel, chacune ayant ses propres avantages et applications.
Une méthode courante implique la réaction entre le nickel métallique ou l’oxyde de nickel avec l’acide chlorhydrique. Dans ce processus, on ajoute du nickel métallique ou de l’oxyde de nickel dans un récipient approprié et on remue tout en ajoutant lentement de l’acide chlorhydrique. La réaction entre le nickel et l’acide produit du dichlorure de nickel ainsi que la libération d’hydrogène gazeux.
Une autre méthode de synthèse implique la réaction entre le carbonate de nickel et l’acide chlorhydrique. L’acide chlorhydrique dissout le carbonate de nickel et la solution chauffée subit une réaction pour former du dichlorure de nickel et libérer du dioxyde de carbone gazeux.
L’acide chlorhydrique subit une réaction avec l’hydroxyde de nickel dissous lorsque la solution est chauffée ou laissée au repos, entraînant la synthèse de dichlorure de nickel. La réaction conduit à la formation de dichlorure de nickel et d’eau.
De plus, on peut préparer du dichlorure de nickel en faisant réagir du nickel métallique avec du chlore gazeux. Cette réaction directe entre les deux éléments donne du dichlorure de nickel.
Ces méthodes de synthèse proposent différentes voies d’obtention du dichlorure de nickel, permettant une flexibilité en termes de matières premières et de conditions de réaction. Le choix de la méthode dépend de facteurs tels que la pureté souhaitée du produit final, la disponibilité des matières premières et les exigences spécifiques de l’application.
Utilisations du chlorure de nickel
Le dichlorure de nickel a diverses applications dans différentes industries en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations notables :
- Galvanoplastie : Les procédés de galvanoplastie utilisent généralement du dichlorure de nickel pour fournir un revêtement protecteur et décoratif sur diverses surfaces. Le dichlorure de nickel améliore l’apparence des métaux comme l’acier, le laiton et le cuivre tout en leur conférant une résistance à la corrosion.
- Catalyseur : Le dichlorure de nickel agit comme catalyseur dans de nombreuses réactions chimiques, notamment les processus d’hydrogénation et de polymérisation. Il facilite la conversion des réactifs en produits souhaités et trouve une application dans la production de produits pharmaceutiques, de plastiques et de fibres synthétiques.
- Synthèse chimique : Le dichlorure de nickel sert de précurseur dans la synthèse de divers composés du nickel, tels que l’oxyde de nickel, le sulfure de nickel et le cyanure de nickel. Les industries utilisent ces composés dans des catalyseurs, des pigments, des céramiques et des matériaux magnétiques.
- Piles : les piles rechargeables, en particulier les piles au nickel-hydrure métallique (NiMH), utilisent du dichlorure de nickel comme électrolyte. Il permet la circulation des ions entre les électrodes pendant les cycles de charge et de décharge.
- Purification des gaz : les industries utilisent du dichlorure de nickel dans les processus de purification des gaz pour éliminer les impuretés comme le sulfure d’hydrogène et le monoxyde de carbone. Il trouve des applications dans le raffinage du gaz naturel et le traitement pétrochimique.
- Complément alimentaire pour animaux : l’alimentation du bétail, en particulier celle des volailles et des porcs, incorpore du dichlorure de nickel comme complément nutritionnel. Il facilite l’activité enzymatique et contribue à la santé globale et à la croissance des animaux.
- Recherche en laboratoire : les chercheurs utilisent le dichlorure de nickel dans diverses expériences en laboratoire, notamment dans des réactions catalysées par le nickel et comme source d’ions nickel pour l’analyse chimique.
Ces diverses applications démontrent la polyvalence et l’importance du dichlorure de nickel dans des secteurs allant de la fabrication et de l’énergie à l’agriculture et à la recherche.
Des questions:
Q : Quels ions sont présents dans une solution aqueuse de NiCl2 ?
R : Dans une solution aqueuse de NiCl2, les ions présents sont Ni2+ (cation nickel) et Cl- (anion chlorure).
Q : Le NiCl2 est-il soluble dans l’eau ?
R : Oui, NiCl2 est soluble dans l’eau et forme une solution aqueuse jaune verdâtre.
Q : Quel métal réagit spontanément avec NiCl2(aq) ?
R : Les métaux tels que le magnésium (Mg) et le zinc (Zn) réagissent spontanément avec NiCl2(aq) pour déplacer le nickel et former leurs chlorures respectifs.
Q : Le NiCl2 est-il polaire ou non polaire ?
R : NiCl2 est un composé polaire en raison de la différence d’électronégativité entre le nickel et le chlore, ce qui entraîne une répartition inégale de la charge.
Q : Le NiCl2 est-il aqueux ?
R : Oui, NiCl2 peut exister à l’état aqueux lorsqu’il est dissous dans l’eau, formant une solution aqueuse.
Q : Quel est le nom du composé de formule NiCl2 ?
R : Le composé de formule NiCl2 est appelé chlorure de nickel (II).
Q : Comment prépareriez-vous 1,00 L d’une solution 0,50 M de NiCl2 ?
R : Pour préparer une solution 0,50 M de NiCl2, dissolvez 129,6 grammes de NiCl2 dans l’eau et complétez le volume à 1,00 L.
Q : Quel est le sel insoluble formé entre une solution de Na2S et NiCl2 ?
R : Lorsqu’une solution de Na2S est mélangée à NiCl2, du sulfure de nickel insoluble (NiS) se forme.
Q : Le NiCl2(aq) est-il un solide ?
R : Non, NiCl2(aq) fait référence à une solution aqueuse de NiCl2, ce qui indique qu’elle est sous forme liquide.
Q : Qu’est-ce qui rend le chlorure de nickel(II) cristallin vert ?
R : La couleur verte du chlorure de nickel (II) cristallin est attribuée à la présence de cations nickel (Ni2+) dans le réseau cristallin.
Q : Le dichlorure de nickel est-il toxique ?
R : Oui, le dichlorure de nickel est toxique et doit être manipulé avec prudence. Il peut provoquer des irritations cutanées et des problèmes respiratoires et est nocif en cas d’ingestion.
Q : Une réaction se produit-elle lorsque des solutions aqueuses de NiCl2 et Na2S sont combinées ?
R : Oui, une réaction se produit lorsque des solutions aqueuses de NiCl2 et Na2S sont combinées, entraînant la formation de sulfure de nickel insoluble (NiS) et de chlorure de sodium soluble (NaCl).
Q : Combien de grammes de NiCl2 sont nécessaires pour neutraliser 75,0 mL d’hydroxyde de lithium 0,555 M ?
R : Environ 18,4 grammes de NiCl2 sont nécessaires pour neutraliser 75,0 ml d’hydroxyde de lithium 0,555 M dans une réaction stoechiométrique.
Q : Que se passe-t-il lorsque vous mélangez du carbonate d’ammonium, du dichlorure de nickel et de l’eau ?
R : Lorsque le carbonate d’ammonium, le dichlorure de nickel et l’eau sont mélangés, une réaction se produit entraînant la formation de chlorure d’ammonium, de carbonate de nickel et d’eau.
