Le chlorure de magnésium (MgCl2) est un composé composé d’ions magnésium et chlorure. Il est couramment utilisé comme complément pour traiter les carences en magnésium et comme dégivrant pour les routes et les trottoirs.
| Nom UICPA | Chlorure de magnesium |
| Formule moléculaire | MgCl2 |
| Numero CAS | 7786-30-3 |
| Synonymes | Dichlorure de magnésium, chloromagnésite, bischloromagnésium, chlorure de magnésium (II), E511, Nigari |
| InChI | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
Formule de chlorure de magnésium
La formule chimique du chlorure de magnésium est MgCl2. Cette formule indique que le chlorure de magnésium est constitué d’un ion Mg+2 et de deux ions Cl-. La formule est importante pour déterminer la quantité de chlorure de magnésium nécessaire aux réactions chimiques. Le chlorure de magnésium est couramment utilisé comme supplément pour traiter les carences en magnésium et comme dégivrant pour les routes et les trottoirs.
Masse molaire du chlorure de magnésium
La masse molaire du chlorure de magnésium est de 95,21 g/mol. C’est un composé cristallin composé d’un ion Mg+2 et de deux ions Cl-. La masse molaire est une propriété importante du chlorure de magnésium car elle est utilisée pour calculer la quantité de substance dans les réactions chimiques. Le chlorure de magnésium est couramment utilisé comme supplément pour traiter les carences en magnésium et comme dégivrant pour les routes et les trottoirs.
Point d’ébullition du MgCl2
Le MgCl2 a un point d’ébullition élevé de 1 412 °C, ce qui signifie qu’il nécessite beaucoup d’énergie pour rompre les liaisons entre ses atomes et ses molécules. Cette propriété le rend utile dans les applications à haute température, comme dans la production de métaux et d’alliages. Le MgCl2 est également utilisé comme dessicant pour absorber l’humidité de l’air et comme catalyseur dans les réactions chimiques.
Point de fusion du MgCl2
Le point de fusion du MgCl2 est de 714°C, ce qui signifie qu’il s’agit d’un solide à température ambiante. Cette propriété le rend utile dans diverses applications, telles que la production de magnésium métallique et comme flux dans le soudage de l’aluminium. Le MgCl2 est également utilisé comme coagulant dans la production de tofu et d’autres produits à base de soja.
Densité MgCl2 g/ml
La densité de MgCl2 est de 2,32 g/ml. Cette propriété le rend utile dans diverses applications, telles que la production de matériaux ignifuges et le traitement des eaux usées. Le MgCl2 est également utilisé comme abat-poussière sur les routes et dans la construction d’autoroutes.
Poids moléculaire du MgCl2
Le poids moléculaire du MgCl2 est de 95,21 g/mol. Cette propriété est importante pour déterminer la quantité de MgCl2 nécessaire aux réactions chimiques. Le MgCl2 est couramment utilisé comme supplément pour traiter les carences en magnésium et comme dégivrant pour les routes et les trottoirs.
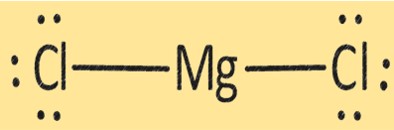
Structure MgCl2
MgCl2 a une structure cristalline composée d’un ion Mg+2 et de deux ions Cl-. La structure du MgCl2 est importante pour déterminer ses propriétés physiques et chimiques. Le MgCl2 est utilisé dans diverses applications, telles que la production de magnésium métallique, comme dessicant et comme coagulant dans la production de tofu et d’autres produits à base de soja.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,32 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 95,21 g/mole |
| Densité | 2,32 g/ml |
| Point de fusion | 714 °C |
| Point d’ébullition | 1412 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, l’éthanol, le méthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 7,6 (pour les ions Mg(H2O)6^2+) |
| pH | 6,0 – 8,0 |
Sécurité et dangers du chlorure de magnésium
Le chlorure de magnésium (MgCl2) est généralement considéré comme sûr lorsqu’il est utilisé selon les instructions. Cependant, cela peut présenter certains dangers s’il n’est pas manipulé correctement. Cela peut provoquer une irritation de la peau et des yeux, et l’inhalation de poussière peut provoquer des problèmes respiratoires. L’ingestion de grandes quantités de MgCl2 peut entraîner des nausées, des vomissements et de la diarrhée. Il peut également être nocif pour la vie aquatique s’il est rejeté dans les cours d’eau. Un équipement de protection approprié, tel que des gants et des lunettes, doit être porté lors de la manipulation du MgCl2. Tout déversement ou rejet doit être confiné et nettoyé immédiatement pour éviter tout dommage environnemental.
| Symboles de danger | Aucun attribué |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. En cas de contact, rincer à l’eau. Portez des gants et des lunettes lors de la manipulation. |
| Numéros d’identification de l’ONU | ONU 2019 |
| Code SH | 28273100 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) – 4 640 mg/kg ; CL50 (inhalation, rat) – >4,4 mg/L pendant 4 heures |
Méthodes de synthèse du chlorure de magnésium
Diverses méthodes peuvent synthétiser le MgCl2, notamment la synthèse directe, la réaction avec l’acide chlorhydrique et la réaction avec MgO.
Pour produire du MgCl2 par synthèse directe, brûlez du magnésium métallique dans l’air ou du chlore gazeux pour créer du MgO. Ensuite, faites réagir MgO avec de l’acide chlorhydrique pour produire du MgCl2 :
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
Une autre méthode consiste à faire réagir du Mg métallique avec de l’acide chlorhydrique pour produire du MgCl2 et de l’hydrogène gazeux :
Mg + 2HCl → MgCl2 + H2
Pour la réaction avec MgO, nous mélangeons MgO avec de l’acide chlorhydrique pour produire du MgCl2 et de l’eau :
MgO + 2HCl → MgCl2 + H2O
Le mélange de MgO avec de l’acide chlorhydrique produit du chlorure de magnésium et de l’eau lors de la réaction avec MgO :
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
De plus, nous pouvons obtenir du MgCl2 comme sous-produit du procédé Solvay, qui produit du carbonate de sodium . Le processus entraîne la production de chlorure de calcium et de MgCl2 comme sous-produits, qui peuvent être séparés de la solution de carbonate de sodium.
Utilisations du chlorure de magnésium
Le chlorure de magnésium a un large éventail d’utilisations dans diverses industries, notamment :
- Agent de dégivrage : Utilisé comme agent de dégivrage sur les routes et les trottoirs pendant les mois d’hiver en raison de sa capacité à abaisser le point de congélation de l’eau.
- Contrôle de la poussière : Utilisé comme agent de contrôle de la poussière sur les routes non pavées et les chantiers de construction.
- Industrie alimentaire : Utilisé comme coagulant dans la production du tofu et comme source de magnésium dans certains produits alimentaires.
- Médecine : Utilisé en médecine comme complément en cas de carence en magnésium et comme traitement de certaines affections, telles que la constipation et les brûlures d’estomac.
- Agriculture : Utilisé comme engrais et amendement du sol pour améliorer la teneur en magnésium du sol et de la croissance des plantes.
- Traitement de l’eau : Utilisé dans les processus de traitement de l’eau pour éliminer les impuretés et adoucir l’eau dure.
- Applications industrielles : Utilisé dans la production de textiles, de papier et de ciment, ainsi que dans divers processus industriels.
- Santé et bien-être : Utilisé dans diverses pratiques de santé et de bien-être, comme le bain, pour favoriser la relaxation et améliorer la santé de la peau.
Des questions:
Q : Quelle est la formule du chlorure de magnésium ?
R : La formule du chlorure de magnésium est MgCl2.
Q : Qu’est-ce que le chlorure de magnésium ?
R : Le MgCl2 est un composé inorganique couramment utilisé dans diverses industries et applications, notamment comme agent de dégivrage, agent de contrôle de la poussière et additif alimentaire.
Q : Le chlorure de magnésium est-il soluble ?
R : Oui, MgCl2 est soluble dans l’eau et d’autres solvants polaires.
Q : Le chlorure de magnésium est-il ionique ou covalent ?
R : MgCl2 est un composé ionique constitué d’un cation (Mg2+) et d’un anion (Cl-).
Q : Qu’est-ce que MgCl2 ?
R : MgCl2 est la formule chimique du chlorure de magnésium, qui est un composé inorganique utilisé dans diverses applications industrielles et grand public.
Q : Quelle est l’équation ionique nette de la réaction de MgCl2 avec NaOH ?
R : L’équation ionique nette pour la réaction de MgCl2 avec NaOH est Mg2+ (aq) + 2OH- (aq) → Mg(OH)2 (s).
