Le chlorure de baryum dihydraté est un composé cristallin blanc de formule chimique BaCl2·2H2O. Il est couramment utilisé en laboratoire comme réactif et dans l’industrie pour le traitement des surfaces métalliques.
| Nom UICPA | Chlorure de baryum dihydraté |
| Formule moléculaire | BaCl2·2H2O |
| Numero CAS | 10326-27-9 |
| Synonymes | Dichlorure de baryum dihydraté ; Chlorure de baryum(II) dihydraté ; Chlorure de baryum hydraté (1:2:2) ; Chlorure de baryum 2-hydraté ; Chlorure de baryum dihydraté; Dichlorure de baryum, dihydraté ; Chlorure de baryum(2+) dihydraté |
| InChI | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
BaCl2·2H2O masse molaire
La masse molaire du chlorure de baryum dihydraté (BaCl2·2H2O) est 244,26 g/mol. Cette valeur peut être calculée en additionnant les masses atomiques de chaque élément présent dans le composé. Le baryum a une masse molaire de 137,33 g/mol, le chlore a une masse molaire de 35,45 g/mol et l’hydrogène et l’oxygène ont des masses molaires de 1,01 g/mol et 16,00 g/mol, respectivement. Les deux molécules d’eau ajoutent 36,02 g/mol supplémentaires. La masse molaire de BaCl2·2H2O est importante dans les calculs stœchiométriques où la quantité de réactif ou de produit est exprimée en moles.
Formule de chlorure de baryum dihydraté
La formule chimique du chlorure de baryum dihydraté est BaCl2·2H2O. Cette formule indique que chaque unité de formule du composé contient un ion baryum, deux ions chlorure et deux molécules d’eau. La formule est importante pour les calculs stœchiométriques et pour comprendre les propriétés chimiques et physiques du composé.
Point d’ébullition du chlorure de baryum dihydraté
BaCl2·2H2O a un point d’ébullition de 1 560 °C. À cette température, le composé subira une transition de phase d’un liquide à un gaz. Le point d’ébullition élevé est dû à la nature ionique du composé, qui nécessite une grande quantité d’énergie pour briser les fortes forces électrostatiques qui maintiennent les ions ensemble. BaCl2 2H2O est utilisé dans l’industrie comme agent de traitement thermique des surfaces métalliques en raison de ses points de fusion et d’ébullition élevés.
Point de fusion du chlorure de baryum dihydraté
Le point de fusion de BaCl2 · 2H2O est de 962 °C. À cette température, le composé passera d’un solide à un liquide. Le point de fusion élevé du BaCl2·2H2O est dû aux fortes liaisons ioniques entre les ions baryum et chlore, ainsi qu’aux liaisons hydrogène entre les molécules d’eau. Le point de fusion du BaCl2·2H2O est une propriété importante pour son utilisation dans diverses applications telles que la production de pigments et de colorants, et le traitement des surfaces métalliques.
Densité du chlorure de baryum dihydraté g/ml
La densité du chlorure de baryum dihydraté est de 3,097 g/cm³. Cela signifie que 1 cm³ de chlorure de baryum dihydraté pèse 3,097 grammes. La densité d’une substance est une propriété importante qui peut donner un aperçu de ses propriétés physiques et chimiques. Dans le cas du chlorure de baryum dihydraté, la densité élevée est due à la masse atomique relativement importante du baryum et à l’empilement compact des ions dans la structure du réseau cristallin.
BaCl2 · 2H2O poids moléculaire
Le poids moléculaire de BaCl2·2H2O est de 244,26 g/mol. Cette valeur peut être calculée en additionnant les poids atomiques de chaque élément présent dans le composé. Le poids moléculaire est une propriété importante du BaCl2 · 2H2O car il est utilisé dans diverses applications telles que la production de pigments et de colorants, et comme réactif dans des expériences en laboratoire.
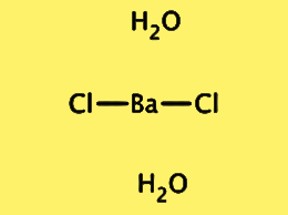
Structure BaCl2·2H2O
La structure cristalline de BaCl2·2H2O est orthorhombique, de groupe spatial Pnma. La cellule unitaire contient une unité de formule de BaCl2·2H2O, composée d’un ion baryum, de deux ions chlorure et de deux molécules d’eau. L’ion baryum est entouré de huit ions chlorure et les molécules d’eau sont liées par hydrogène aux ions chlorure. La structure cristalline du BaCl2 · 2H2O est importante pour comprendre ses propriétés physiques et chimiques, ainsi que pour son utilisation dans diverses applications.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 3,097 g/cm³ |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 244,26 g/mole |
| Densité | 3,097 g/cm³ |
| Point de fusion | 962 °C |
| Point d’ébullition | 1560 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 31,2 g/100 mL (à 20°C) |
| Solubilité | Soluble dans l’alcool et l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre (7) |
Remarque : Le tableau peut ne pas être correctement aligné en fonction des paramètres d’affichage de la plate-forme ou de l’appareil que vous utilisez.
Sécurité et dangers du chlorure de baryum dihydraté
BaCl2 2H2O présente plusieurs risques pour la sécurité et la santé, qui peuvent être nocifs s’ils ne sont pas manipulés correctement. C’est une substance corrosive qui peut provoquer de graves brûlures à la peau et aux yeux au contact. L’inhalation de ses poussières ou de ses vapeurs peut entraîner des problèmes respiratoires et des lésions pulmonaires. Il est également toxique en cas d’ingestion et peut provoquer des problèmes gastro-intestinaux. BaCl2 2H2O doit être manipulé avec prudence et des équipements de protection appropriés tels que des gants, des lunettes et des masques respiratoires doivent être portés lorsque vous travaillez avec le composé. Il doit être stocké à l’écart des substances incompatibles et dans une zone sécurisée pour éviter toute exposition accidentelle. En cas d’urgence, consultez immédiatement un médecin.
| Symboles de danger | Corrosif (C) | |
| Description de la sécurité | ||
| Identifiants ONU | UN1564 | |
| Code SH | 28273990 | |
| Classe de danger | 8 | |
| Groupe d’emballage | III | |
| Toxicité | Toxique en cas d’ingestion ; peut causer des problèmes gastro-intestinaux. Corrosif pour la peau et les yeux. L’inhalation de poussières ou de vapeurs peut entraîner des problèmes respiratoires et des lésions pulmonaires. | |
Méthodes de synthèse du chlorure de baryum dihydraté
Vous pouvez synthétiser BaCl2 2H2O par plusieurs méthodes.
Une méthode courante consiste à faire réagir le carbonate de baryum ou l’hydroxyde de baryum avec de l’acide chlorhydrique. Vous devez évaporer la solution obtenue pour obtenir le composé solide.
Une autre méthode consiste à faire réagir le sulfure de baryum avec de l’acide chlorhydrique. Cette réaction produit du sulfure d’hydrogène gazeux, que vous devez évacuer correctement. La solution obtenue est ensuite purifiée par filtration et cristallisation pour obtenir le produit final.
Vous pouvez également synthétiser BaCl2 2H2O par une réaction de précipitation utilisant du chlorure de sodium et du nitrate de baryum. Vous devez mélanger les deux composés dans une solution, puis filtrer et sécher le précipité obtenu pour obtenir le composé solide.
De plus, BaCl2 · 2H2O peut être synthétisé par la réaction de l’oxyde de baryum avec l’acide chlorhydrique. Cette réaction produit de l’eau comme sous-produit, que vous devez éliminer par évaporation. La solution obtenue est ensuite cristallisée pour obtenir le produit final.
Lorsque vous travaillez avec BaCl2 2H2O, vous devez prendre les précautions de sécurité appropriées car il s’agit d’un composé corrosif et toxique. Vous devez porter des équipements de protection tels que des gants, des lunettes et des masques respiratoires, et manipuler le composé dans un endroit bien ventilé.
Utilisations du chlorure de baryum dihydraté
BaCl2 2H2O a plusieurs utilisations dans diverses industries.
- L’industrie chimique utilise BaCl2 · 2H2O comme réactif dans plusieurs réactions chimiques, telles que la production de sels de baryum, de pigments et de céramiques.
- Il fonctionne comme flux dans le raffinage des métaux et comme catalyseur dans la synthèse organique.
- L’industrie médicale utilise BaCl2 2H2O comme agent de contraste en radiographie et pour traiter l’empoisonnement au baryum. Il est également utilisé dans la fabrication de ciments dentaires.
- L’industrie textile utilise BaCl2 2H2O comme mordant, substance qui lie les colorants aux fibres, et comme ignifuge pour les textiles.
- Dans l’industrie pétrolière, BaCl2 2H2O sert d’additif à la boue de forage pour augmenter la densité de la boue et prévenir les éruptions pendant les opérations de forage.
- L’industrie alimentaire utilise BaCl2 2H2O comme conservateur et exhausteur de goût pour certains aliments.
Des précautions de sécurité appropriées, telles que le port d’un équipement de protection et la manipulation du composé dans un endroit bien ventilé, doivent être prises pour minimiser les risques associés au travail avec le BaCl2 2H2O corrosif et toxique.
Des questions:
Quelle est la formule du chlorure de baryum dihydraté ?
La formule du chlorure de baryum dihydraté est BaCl2·2H2O.
Le chlorure de baryum dihydraté est-il soluble dans l’eau ?
Oui, le chlorure de baryum dihydraté est hautement soluble dans l’eau. Il se dissout facilement dans l’eau, avec une solubilité d’environ 31,2 g/100 mL à température ambiante. Cette haute solubilité en fait un composé utile dans diverses industries, comme dans la production de sels de baryum et comme additif pour boue de forage dans l’industrie pétrolière. Cependant, sa grande solubilité signifie également qu’il peut présenter un risque pour la santé humaine et l’environnement s’il n’est pas manipulé correctement, car il peut contaminer les sources d’eau et entraîner une toxicité pour les organismes aquatiques. Par conséquent, des précautions appropriées doivent être prises lorsque vous travaillez avec BaCl2 2H2O pour éviter toute contamination et garantir une manipulation sûre.
