Le chlorure d’ammonium ou NH4Cl est un sel cristallin blanc utilisé dans diverses applications, notamment en médecine et dans les engrais. Il est formé par la réaction de l’ammoniac et de l’acide chlorhydrique et a un goût salé distinct.
| Nom UICPA | Chlorure d’ammonium |
| Formule moléculaire | NH4Cl |
| Numero CAS | 12125-02-9 |
| Synonymes | Sal ammoniaque, Salmiac, sel de Nushadir, Amchlor, Sal armagnac, Hydrochlorate, Muriate d’ammonium, Sal armagnac |
| InChI | InChI=1S/ClH.H3N/h1H;1H3 |
NH4Cl masse molaire
Le chlorure d’ammonium a une masse molaire de 53,49 g/mol. La masse molaire fait référence à la masse d’une mole d’une substance et est exprimée en grammes par mole (g/mol). La masse molaire du chlorure d’ammonium est déterminée en additionnant les masses atomiques de ses atomes constitutifs, qui sont l’azote (N), l’hydrogène (H) et le chlore (Cl). La formule moléculaire du chlorure d’ammonium est NH4Cl, ce qui signifie qu’il contient un atome d’azote, quatre atomes d’hydrogène et un atome de chlore. Par conséquent, la masse molaire du chlorure d’ammonium peut être calculée comme suit
Masse molaire = (1 x masse atomique de N) + (4 x masse atomique de H) + (1 x masse atomique de Cl)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 g/mole
Point d’ébullition du chlorure d’ammonium
Le point d’ébullition du chlorure d’ammonium est de 520 °C (968 °F). Le point d’ébullition est la température à laquelle la pression de vapeur d’un liquide est égale à la pression externe qui lui est appliquée. À cette température, le chlorure d’ammonium s’évapore et se transforme en état gazeux. Le point d’ébullition élevé du chlorure d’ammonium est dû à ses fortes liaisons ioniques entre les ions ammonium (NH4+) et chlorure (Cl-).
Point de fusion du chlorure d’ammonium
Le point de fusion du chlorure d’ammonium est de 338 °C (640 °F). Le point de fusion est la température à laquelle un solide se transforme en liquide. À cette température, les liaisons ioniques entre les ions ammonium (NH4+) et chlorure (Cl-) sont rompues et le chlorure d’ammonium passe d’un solide à un liquide. Le chlorure d’ammonium a un point de fusion relativement bas par rapport à d’autres composés ioniques, ce qui le rend utile dans certaines applications telles que la soudure et la métallurgie.
Densité du chlorure d’ammonium g/ml
La densité du chlorure d’ammonium est de 1,527 g/cm³. La densité est une mesure de la quantité de masse par unité de volume d’une substance. La haute densité du chlorure d’ammonium est due à sa structure de réseau ionique très compacte. Le chlorure d’ammonium a une densité plus élevée que l’eau, ce qui signifie qu’il coulera dans l’eau.
Poids moléculaire du chlorure d’ammonium
Le poids moléculaire du chlorure d’ammonium est de 53,49 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire du chlorure d’ammonium est le même que sa masse molaire.
Structure du chlorure d’ammonium
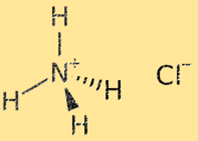
La structure du chlorure d’ammonium est un réseau cristallin composé d’ions alternés ammonium (NH4+) et chlorure (Cl-). L’ion ammonium est un ion polyatomique de charge positive (+1), constitué d’un atome d’azote et de quatre atomes d’hydrogène. L’ion chlorure est un ion monoatomique de charge négative (-1), constitué d’un atome de chlore. La structure du réseau cristallin du chlorure d’ammonium est stabilisée par de fortes liaisons ioniques entre les ions ammonium et chlorure, ce qui donne un solide très stable et cassant.
Formule de chlorure d’ammonium
La formule du chlorure d’ammonium est NH4Cl. Il est composé d’un ion ammonium (NH4+) et d’un ion chlorure (Cl-). La formule représente le rapport des atomes dans une molécule et montre que pour chaque ion ammonium, il existe un ion chlorure. La formule du chlorure d’ammonium est utilisée pour déterminer la masse molaire, la densité et d’autres propriétés du composé.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,527 g/cm³ |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 53,49 g/mole |
| Densité | 1,527 g/cm³ |
| Point de fusion | 338 °C (640 °F) |
| Point d’ébullition | 520 °C (968 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 29,7 g/100 ml (25 °C) |
| Solubilité | Soluble dans l’éthanol et l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | 9h25 |
| pH | 4,6 (solution à 5 %) |
Sécurité et dangers du chlorure d’ammonium
Le chlorure d’ammonium (NH4Cl) est généralement considéré comme sans danger pour une utilisation normale. Cependant, il peut être nocif s’il est ingéré ou inhalé en grande quantité. L’ingestion de NH4Cl peut provoquer une irritation de la bouche et de la gorge, des nausées, des vomissements et de la diarrhée. L’inhalation de NH4Cl peut provoquer une irritation du système respiratoire, de la toux et un essoufflement. Le NH4Cl doit être manipulé avec précaution, car il peut provoquer une irritation de la peau et des yeux. Il est également important d’éviter toute exposition aux poussières ou aux vapeurs de NH4Cl, qui peuvent être irritantes pour les yeux, le nez et la gorge. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lors de la manipulation du NH4Cl.
| Symboles de danger | XI |
| Description de la sécurité | S22, S24/25, S36/37/39 |
| Numéros d’identification de l’ONU | ONU 3077 |
| Code SH | 2827.10.00 |
| Classe de danger | 9 – Marchandises dangereuses diverses |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité, mais peut être nocif en cas d’ingestion ou d’inhalation en grande quantité. |
Méthodes de synthèse du chlorure d’ammonium
On peut synthétiser du chlorure d’ammonium (NH4Cl) par diverses méthodes.
- Une méthode courante consiste à faire réagir l’ammoniac gazeux avec de l’acide chlorhydrique dans l’eau. Cette réaction exothermique produit du NH4Cl sous forme de solide cristallin blanc. Il est important d’ajouter l’acide chlorhydrique à l’eau lentement tout en remuant pour éviter les éclaboussures dues à la chaleur générée.
- Une autre méthode de production de NH4Cl est celle d’un sous-produit de divers procédés industriels tels que la production de carbonate de sodium ou le procédé Solvay.
- Une autre façon de synthétiser le NH4Cl consiste à faire réagir l’ammoniac avec du chlorure de sodium. Cette réaction produit à la fois du NH4Cl et de l’hydroxyde de sodium. Cette réaction est exothermique et nécessite un contrôle minutieux pour éviter la formation de sous-produits indésirables.
Utilisations du chlorure d’ammonium
Le chlorure d’ammonium (NH4Cl) a de nombreuses utilisations dans différentes industries.
- Le NH4Cl sert d’engrais en agriculture, fournissant des nutriments essentiels aux cultures comme l’azote et le chlorure, améliorant ainsi le rendement et la qualité.
- Le chlorure d’ammonium facilite le bon fonctionnement des piles sèches en conduisant l’électricité comme électrolyte.
- L’industrie textile utilise le NH4Cl comme agent de teinture et d’impression, ce qui contribue à fixer les colorants sur les tissus et à améliorer la solidité des couleurs.
- En tant que flux dans le travail des métaux et le brasage, le NH4Cl élimine les couches d’oxyde des métaux, permettant ainsi un soudage plus facile.
- Le produit chimique a des applications dans l’alimentation, les produits pharmaceutiques et les cosmétiques en tant qu’agent aromatisant, expectorant dans les médicaments contre la toux et ingrédient dans les produits de soins personnels.
Dans l’ensemble, les propriétés uniques du NH4Cl en font un produit chimique polyvalent avec de nombreuses applications importantes dans différentes industries.
Des questions:
Q : Le chlorure d’ammonium est-il sublime ?
R : Oui, le chlorure d’ammonium est connu pour se sublimer, ce qui signifie qu’il peut passer directement d’une phase solide à une phase gazeuse sans fondre entre les deux.
Q : Le NH4Cl est-il acide ou basique ?
R : Le chlorure d’ammonium est un sel acide. Lorsqu’il est dissous dans l’eau, il peut subir une hydrolyse pour produire une solution acide. Cela est dû au fait que l’ion ammonium agit comme un acide faible et donne un proton (H+) aux molécules d’eau.
Q : Quelle est la formule du chlorure d’ammonium ?
R : La formule du chlorure d’ammonium est NH4Cl. Il est composé d’un ion ammonium (NH4+) et d’un ion chlorure (Cl-) maintenus ensemble par des liaisons ioniques.
Q : Le chlorure d’ammonium se dissout-il dans l’eau ?
R : Oui, le chlorure d’ammonium est hautement soluble dans l’eau. À température ambiante, environ 29,7 grammes de chlorure d’ammonium peuvent se dissoudre dans 100 millilitres d’eau.
Q : Comment séparer le chlorure d’ammonium et le chlorure de sodium ?
R : Une façon de séparer le chlorure d’ammonium et le chlorure de sodium est la sublimation. Ceci peut être réalisé en chauffant le mélange, provoquant la sublimation du chlorure d’ammonium tandis que le chlorure de sodium reste sous forme solide. Le chlorure d’ammonium sublimé peut ensuite être collecté et recondensé sous une forme solide. Une autre méthode consiste à dissoudre le mélange dans l’eau puis à précipiter sélectivement l’un des sels à l’aide d’un réactif spécifique ou d’un ajustement du pH.
