Le chlorure d’allyle est un liquide clair et inflammable avec une odeur âcre. Il est utilisé dans la production de divers composés organiques et comme solvant. Il peut être nocif pour les humains s’il est inhalé ou ingéré.
| Nom de l’UICPA | 3-chloroprop-1-ène |
| Formule moléculaire | C3H5Cl |
| Numero CAS | 107-05-1 |
| Synonymes | Chlorure de 2-propényle, 3-chloropropène, chloropropène, chlorure d’allyle, 3-chloro-1-propène, 1-chloro-2-propène |
| InChI | InChI=1S/C3H5Cl/c1-2-3-4/h2H,1,3H2 |
Propriétés du chlorure d’allyle
Formule de chlorure d’allyle
La formule chimique du chlorure d’allyle est C3H5Cl. C’est un liquide clair et incolore avec une odeur âcre. La structure du chlorure d’allyle est constituée d’une molécule de propène avec un atome de chlore attaché au deuxième atome de carbone. C’est un intermédiaire important dans la production de divers composés organiques, tels que les époxydes, les allylamines et les alcools allyliques.
Chlorure D’allyle Masse molaire
La masse molaire du 3-chloropropène est de 76,53 g/mol. Ceci est calculé en additionnant les poids atomiques du carbone, de l’hydrogène et du chlore, qui sont respectivement de 12,01 g/mol, 1,01 g/mol et 35,45 g/mol. La masse molaire est une propriété importante d’un composé chimique car elle est utilisée pour calculer la quantité de substance dans une masse donnée.
Point d’ébullition du chlorure d’allyle
Le point d’ébullition du 3-chloropropène est de 46,05 °C (114,9 °F). Ceci est relativement faible par rapport à d’autres composés organiques, ce qui fait du 3-chloropropène une substance volatile. Le faible point d’ébullition rend également le 3-chloropropène utile dans les processus industriels car il peut être facilement évaporé et condensé pour le purifier.
Point de fusion du chlorure d’allyle
Le point de fusion du 3-chloropropène est de -136 °C (-213 °F). Il s’agit d’une température très basse et signifie que le 3-chloropropène existe sous forme liquide à température ambiante. Cependant, lorsque le 3-chloropropène est refroidi à des températures très basses, il peut se solidifier sous une forme cristalline blanche.
Densité du chlorure d’allyle g/mL
La densité du 3-chloropropène est de 0,950 g/mL. Cela signifie que le 3-chloropropène est plus dense que l’eau, qui a une densité de 1 g/mL. La haute densité du 3-chloropropène le rend utile pour le séparer d’autres substances de densité plus faible, comme l’eau.
Chlorure d’allyle Poids moléculaire
Le poids moléculaire du 3-chloropropène est de 76,53 g/mol. Cette valeur est calculée en additionnant les poids atomiques de tous les atomes de la molécule. Le poids moléculaire est important pour déterminer les propriétés physiques et chimiques d’un composé.
Structure du chlorure d’allyle
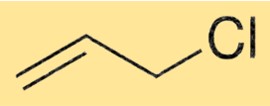
La structure du 3-chloropropène consiste en une molécule de propène avec un atome de chlore attaché au deuxième atome de carbone. Cela forme un groupe vinyle, qui est un groupe fonctionnel en chimie organique. Le groupe vinyle est responsable de la réactivité du 3-chloropropène dans diverses réactions chimiques.
Solubilité du chlorure d’allyle
Le 3-chloropropène est soluble dans de nombreux solvants organiques, tels que l’éther et le benzène, mais est insoluble dans l’eau. La solubilité du 3-chloropropène dans différents solvants est due à sa nature polaire. La polarité du 3-chloropropène est déterminée par la différence d’électronégativité entre la liaison carbone-hydrogène et la liaison carbone-chlore.
| Apparence | Liquide clair et incolore |
| Densité spécifique | 0,950 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 76,53 g/mole |
| Densité | 0,950 g/ml |
| Point de fusion | -136 °C (-213 °F) |
| Point d’ébullition | 46,05 °C (114,9 °F) |
| Point d’éclair | -13 °C (9 °F) |
| Solubilité dans l’eau | < 1 g/L |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 21,5 kPa à 20°C |
| Densité de vapeur | 2,64 (air = 1) |
| pKa | 9.18 |
| pH | Non applicable (le pH n’est défini que pour les solutions aqueuses) |
Sécurité et dangers du chlorure d’allyle
Le 3-chloropropène est une substance hautement toxique et corrosive. Il peut provoquer de graves brûlures de la peau et des lésions oculaires au contact et peut être nocif en cas d’inhalation ou d’ingestion. Il est également hautement inflammable et peut réagir violemment avec certains composés. Des précautions de sécurité appropriées doivent être prises lorsque vous travaillez avec du 3-chloropropène, notamment le port de vêtements de protection, de gants et de lunettes de protection. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des sources de chaleur et d’inflammation. En cas d’exposition ou d’ingestion, des soins médicaux doivent être immédiatement recherchés. Il est important de suivre les protocoles de sécurité appropriés pour éviter les accidents et les blessures lors de la manipulation du 3-chloropropène.
| Symboles de danger | T, C |
| Description de la sécurité | Très inflammable, toxique et corrosif. Provoque de graves brûlures de la peau et des lésions oculaires. Nocif en cas d’inhalation ou d’ingestion. |
| Numéros d’identification de l’ONU | ONU 1100 |
| Code SH | 2903.39.90 |
| Classe de danger | Classe 3 (Liquides inflammables), Classe 6.1 (Substances toxiques), Classe 8 (Substances corrosives) |
| Groupe d’emballage | II |
| Toxicité | DL50 = 250 mg/kg (orale, rat) ; CL50 = 1220 ppm (inhalation, rat, 4h) |
Méthodes de synthèse du chlorure d’allyle
Plusieurs méthodes permettent de synthétiser le 3-chloropropène.
L’une des méthodes les plus courantes consiste à ajouter du chlorure d’hydrogène gazeux à l’alcool allylique en présence d’un catalyseur. Une autre méthode implique la réaction du propylène avec du chlore gazeux en présence d’un catalyseur pour former du 3-chloropropène.
Pour préparer le 3-chloropropène, on peut faire réagir l’alcool allylique avec du chlorure de thionyle ou du trichlorure de phosphore. Cette réaction consiste à convertir l’alcool en son chlorure correspondant par une réaction de substitution nucléophile.
Une troisième méthode de préparation du 3-chloropropène implique la réaction du bromure d’allyle avec du chlorure de sodium en présence de poudre de cuivre. Les chimistes utilisent souvent cette méthode lorsqu’ils ont facilement accès au bromure d’allyle mais ne disposent pas de 3-chloropropène.
Une autre méthode de synthèse du 3-chloropropène implique la réaction de l’alcool allylique avec du chlorure d’hydrogène gazeux en présence d’un agent déshydratant tel que le chlorure de zinc. Les chimistes utilisent souvent cette méthode pour préparer du 3-chloropropène avec un rendement et une pureté élevés.
Utilisations du chlorure d’allyle
Le 3-chloropropène a plusieurs utilisations importantes dans diverses industries en raison de ses propriétés uniques :
- Production de composés allyliques : le 3-chloropropène sert de précurseur à divers composés allyliques tels que l’alcool allylique, l’allylamine et les esters allyliques. La production de produits pharmaceutiques, de parfums et d’arômes implique généralement l’utilisation de composés allyliques.
- Production de polymères : les fabricants utilisent le 3-chloropropène comme monomère pour produire divers polymères, tels que le poly3-chloropropène et le carbonate d’allyle diglycol.
- Solvant : Utilisé comme solvant pour divers composés organiques en raison de son faible point d’ébullition et de sa polarité élevée.
- Pesticide : Utilisé comme fumigant et stérilisant du sol en agriculture pour lutter contre les ravageurs et les mauvaises herbes.
- Production de colorants et de pigments : utilisé dans la production de colorants et de pigments pour les industries du textile et de la peinture.
- Industrie pétrolière et gazière : également utilisé dans l’industrie pétrolière et gazière comme inhibiteur de corrosion, lubrifiant et additif pour fluide de forage.
Des questions:
Q : Pourquoi le chlorure d’allyle subit-il des réactions SN1 même s’il s’agit d’un halogénure à 1° ?
R : Le 3-chloropropène subit des réactions SN1 en raison de la stabilité du carbocation intermédiaire, qui est stabilisé par résonance par le groupe allyle.
Q : Qu’arrive-t-il au chlorure d’allyle dans une réaction SN2 ?
R : Dans une réaction SN2, le nucléophile attaque le carbone allylique par l’arrière, conduisant à l’inversion de la stéréochimie et à la formation de l’alcool allylique ou de l’amine correspondant.
Q : Le chlorure d’allyle est-il primaire, secondaire ou tertiaire ?
R : Le 3-chloropropène est un halogénure primaire.
Q : Laquelle des réactions suivantes se produit plus rapidement : AcO- + 3-chloropropène ou MeO- + 3-chloropropène ? R : MeO- + 3-chloropropène se produit plus rapidement que AcO- + 3-chloropropène en raison de l’encombrement stérique provoqué par le plus grand groupe acétyle de ce dernier.
Q : Le chlorure d’allyle est-il un halogénure de vinyle primaire ?
R : Oui, le 3-chloropropène est un halogénure de vinyle primaire.
Q : Comment peut-on fabriquer de l’épichlorhydrine à partir du chlorure d’allyle ?
R : L’épichlorhydrine peut être fabriquée à partir de 3-chloropropène par une réaction d’époxydation utilisant un mélange d’hypochlorite de sodium et d’acide chlorhydrique.
