Le chlorate de sodium est un composé chimique de formule NaClO3. C’est un puissant agent oxydant couramment utilisé dans la production d’allumettes, de colorants et d’herbicides.
| Nom UICPA | Chlorate de sodium |
| Formule moléculaire | NaClO3 |
| Numero CAS | 7775-09-9 |
| Synonymes | Acide chlorique, sel de sodium ; Naclo3; Acide chlorique, sel de sodium (1:1) ; UN1495 ; Chlorate de sodium ; Chlorure de sodium ; |
| InChI | InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
Propriétés du chlorate de sodium
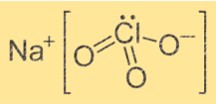
Formule de chlorate de sodium
La formule chimique du chlorate de sodium est NaClO3. C’est un composé ionique composé d’un ion Na+ et d’un ion ClO3-. L’ion Na+ a une charge positive, tandis que l’ion ClO3- a une charge négative. La formule indique qu’un ion Na+ est combiné avec un ion ClO3- pour former le composé.
Chlorate De Sodium Masse molaire
La masse molaire de NaClO3 est de 106,44 g/mol. Il s’agit de la masse d’une mole du composé, qui contient le nombre de molécules d’Avogadro (6,022 x 10 ^ 23). Il est calculé en additionnant les masses atomiques de tous les atomes du composé.
Point d’ébullition du chlorate de sodium
Le point d’ébullition de NaClO3 est de 300°C (572°F). C’est la température à laquelle le composé passe de l’état liquide à l’état gazeux. Le point d’ébullition est déterminé par la force des forces intermoléculaires entre les molécules.
Point de fusion du chlorate de sodium
Le point de fusion de NaClO3 est de 248°C (478°F). C’est la température à laquelle le composé passe de l’état solide à l’état liquide. Le point de fusion est déterminé par la force des forces intermoléculaires entre les molécules.
Densité du chlorate de sodium g/mL
La densité de NaClO3 est de 2,49 g/mL. C’est la masse du composé par unité de volume. La densité est déterminée par la masse et le volume de la substance.
Chlorate De Sodium Poids moléculaire
Le poids moléculaire de NaClO3 est de 106,44 g/mol. C’est la somme des poids atomiques de tous les atomes du composé.
Structure du chlorate de sodium
La structure du NaClO3 est cristalline. L’ion Na+ est entouré de six atomes d’oxygène provenant de six ions ClO3- différents. Les ions ClO3- forment une forme tétraédrique autour de l’ion Na+. La structure est maintenue ensemble par des liaisons ioniques entre l’ion Na+ et les ions ClO3-.
Solubilité du chlorate de sodium
NaClO3 est soluble dans l’eau, l’éthanol et le méthanol. Il se dissout facilement dans l’eau pour former une solution claire et incolore. La solubilité du NaClO3 dans l’eau augmente avec la température. A 20°C, la solubilité est de 85 g/100 mL d’eau.
| Apparence | Solide blanc |
| Gravité spécifique | 2,49 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 106,44 g/mole |
| Densité | 2,49 g/ml |
| Point de fusion | 248°C (478°F) |
| Point d’ébullition | 300°C (572°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 85 g/100 ml |
| Solubilité | Soluble dans l’eau, l’éthanol et le méthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre (7) |
Sécurité et dangers du chlorate de sodium
NaClO3 est un agent oxydant puissant et doit être manipulé avec précaution. Il existe un risque potentiel d’incendie et d’explosion lorsqu’il entre en contact avec des matières organiques telles que le papier, le bois ou l’huile. Il peut également réagir violemment avec les agents réducteurs, les acides et les poudres métalliques. L’ingestion ou l’inhalation de NaClO3 peut avoir des effets graves sur la santé, tels que des problèmes respiratoires, des douleurs abdominales et des vomissements. NaClO3 peut également irriter la peau, les yeux et le système respiratoire. Un équipement de protection approprié, notamment des gants, des lunettes et un respirateur, doit être porté lorsque vous travaillez avec du NaClO3 pour éviter l’exposition et les dangers potentiels.
| Symboles de danger | Agent d’oxydation |
| Description de la sécurité | Nocif en cas d’ingestion, provoque une sévère irritation des yeux, peut provoquer une irritation des voies respiratoires |
| Numéros d’identification de l’ONU | ONU 1495 |
| Code SH | 2829.19.00 |
| Classe de danger | 5.1 (Matières comburantes) |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation, irritant pour la peau et les yeux |
Méthodes de synthèse du chlorate de sodium
Plusieurs méthodes existent pour synthétiser NaClO3.
Une méthode courante consiste à électrolyser une solution de chlorure de sodium . Cela implique de faire passer un courant électrique à travers la solution, ce qui provoque la décomposition du chlorure de sodium en NaClO3 et en chlore gazeux. Une autre méthode consiste à faire réagir l’hydroxyde de sodium avec du chlore gazeux pour former du NaClO3 et du chlorure de sodium.
Une troisième méthode implique la réaction du carbonate de sodium avec du chlore gazeux en présence d’un catalyseur. Cela produit du NaClO3, du chlorure de sodium et du dioxyde de carbone. La réaction entre l’hypochlorite de sodium et l’hydroxyde de sodium peut produire du NaClO3 comme alternative. Cette réaction entraîne la formation de NaClO3, de chlorure de sodium et d’eau.
En plus de ces méthodes, NaClO3 peut également être produit par la réaction du chlorite de sodium avec le peroxyde d’hydrogène. Cette réaction entraîne la formation de NaClO3, d’eau et d’oxygène gazeux.
Utilisations du chlorate de sodium
NaClO3 a diverses utilisations dans diverses industries. Certaines de ses utilisations courantes incluent :
- Herbicide : Largement utilisé comme herbicide, en particulier pour lutter contre les mauvaises herbes dans les zones non cultivées telles que les bords des routes, les voies ferrées et les lignes électriques. En perturbant la photosynthèse des plantes, il peut contrôler efficacement diverses mauvaises herbes.
- Agent de blanchiment : Utilisé dans l’industrie des pâtes et papiers comme agent de blanchiment. Il est particulièrement efficace dans la production de papier blanc brillant de haute qualité.
- Exploitation minière : Utilisé dans l’industrie minière comme agent oxydant pour l’extraction de l’or et d’autres métaux précieux.
- Explosifs : Utilisé comme ingrédient dans la fabrication d’explosifs tels que la dynamite et le chlorate d’ammonium.
- Colorants et pigments : Utilisés dans la production de colorants et de pigments, notamment pour la coloration des textiles.
- Laboratoire : Utilisé en laboratoire comme réactif pour diverses réactions chimiques.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour contrôler la croissance des algues et comme désinfectant.
- Conservateur alimentaire : Également utilisé comme conservateur alimentaire pour prolonger la durée de conservation de certains aliments.
Des questions:
Q : Comment fabriquer du chlorate de sodium ?
R : NaClO3 peut être fabriqué par plusieurs méthodes telles que l’électrolyse d’une solution de chlorure de sodium, la réaction de l’hydroxyde de sodium avec du chlore gazeux et la réaction du carbonate de sodium avec du chlore gazeux en présence d’un catalyseur.
Q : Combien de temps faut-il au chlorate de sodium pour tuer les mauvaises herbes ?
R : NaClO3 est un herbicide puissant et peut tuer les mauvaises herbes quelques jours après son application. Le temps nécessaire pour détruire les mauvaises herbes peut varier en fonction de facteurs tels que la concentration de NaClO3 utilisée et le type de mauvaise herbe ciblée.
Q : Le chlorate de sodium est-il une substance pure ?
R : Oui, NaClO3 est une substance pure car c’est un composé composé uniquement d’atomes de sodium, de chlore et d’oxygène.
Q : Le chlorate de sodium est-il soluble dans l’eau ?
R : Oui, NaClO3 est hautement soluble dans l’eau. Il peut se dissoudre dans l’eau pour former une solution claire et incolore.
Q : Combien d’atomes d’oxygène y a-t-il dans une molécule de chlorate de sodium ?
R : Une molécule NaClO3 possède trois atomes d’oxygène. Sa formule chimique est NaClO3.
Q : Le chlorate de sodium est-il ionique ou covalent ?
R : NaClO3 est un composé ionique. Il est formé par le transfert d’électrons des atomes de sodium vers les atomes de chlore pour former des ions Na+ chargés positivement et des ions NaClO3 chargés négativement.
